
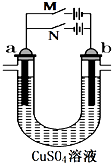
 第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;
第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;| 0.224L |
| 22.4L/mol |
| 4 |
| 2 |
| 0.056 |
| 22.4 |
| 4 |
| 2 |
| ||
| 0.5L |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
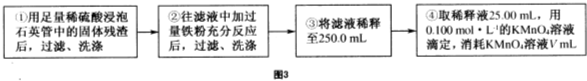
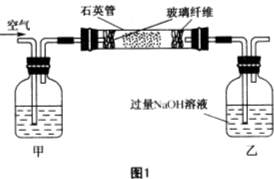 黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
黄铁矿(主要成分为FeS2,含少量其他金属硫化物)曾是我国一些硫酸厂制取硫酸够主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
| ||
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验内容:将木炭与浓硫酸共热,得到的气体通入澄清石灰水.实验目的:检验木炭的氧化产物是CO2. |
| B、实验内容:加入足量铁屑,充分反应后,过滤.实验目的:除去FeCl2溶液中的少量FeCl3. |
| C、实验内容:将1moLCuSO4?5H2O溶解在1L 水中.实验目的:制备1moL/L的CuSO4溶液 |
| D、实验内容:饱和氯化铁溶液中滴加氨水.实验目的:制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度计的水银球应插入蒸馏烧瓶内的自来水中 |
| B、冷凝管内水的流向是下进上出 |
| C、实验中需在自来水中加几片碎瓷片 |
| D、蒸馏烧瓶底部必须垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、3v(NH3)=2v(H2O) |
| D、5v(O2)=4v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O、Na2O2组成元素相同,但与CO2反应的产物不同 |
| B、2Na2O2+2H2O═4NaOH+O2↑ Na2O2是氧化剂H2O是还原剂 |
| C、Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O═2Na++2OH-十O2↑ |
| D、Na2O2用作呼吸面具的供氧剂时氧元素即被氧化又被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com