
| A、温度计的水银球应插入蒸馏烧瓶内的自来水中 |
| B、冷凝管内水的流向是下进上出 |
| C、实验中需在自来水中加几片碎瓷片 |
| D、蒸馏烧瓶底部必须垫石棉网 |


科目:高中化学 来源: 题型:
| A、容量瓶中含有少量蒸馏水 |
| B、将溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C、定容时观察液面俯视 |
| D、定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
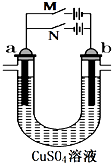 第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;
第一阶段:合上M断开N,a极上产224mL(标准状况,下同)气体,b极上有金属析出;查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
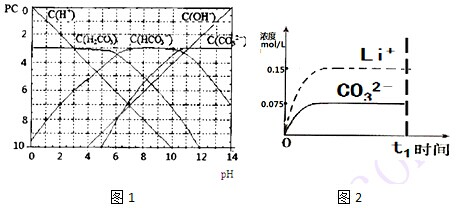
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是纯天然饮品,不含任何化学物质 |
| B、它清洁、纯净,但长期饮用对健康无益 |
| C、它含有人体所需的矿物质和多种微量元素 |
| D、用催化剂可将它转化为汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com