
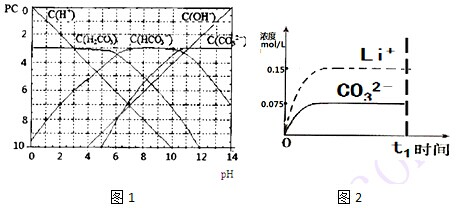
| [H+]?[HCO32-] |
| [H2CO3] |
| 0.1L×0.075mol/L+0.1L×0.125mol/L |
| 0.2L |
| [H+]?[HCO3-] |
| [H2CO3] |
| [H+]?[CO32-] |
| [HCO3-] |
| [H+]?[CO32-] |
| [HCO3-] |
| 0.1L×0.075mol/L+0.1L×0.125mol/L |
| 0.2L |
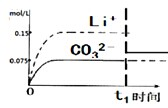 ,
, .
.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
| A、用干冰保藏易变质的食品 |
| B、用硫磺熏制白木耳、粉丝等食品 |
| C、用甲醛浸泡易腐烂的食品 |
| D、用含亚硝酸钠的工业用盐腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
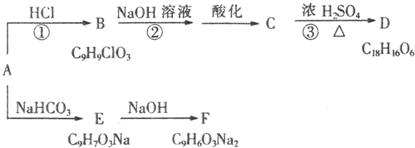
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度计的水银球应插入蒸馏烧瓶内的自来水中 |
| B、冷凝管内水的流向是下进上出 |
| C、实验中需在自来水中加几片碎瓷片 |
| D、蒸馏烧瓶底部必须垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 18×10-5 | 4.5×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b |
| C、向0.1 mol?L-1CH3COOH溶液中逐滴加水,则醋酸的电离程度增大、c(H+)减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、3v(NH3)=2v(H2O) |
| D、5v(O2)=4v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:3 |
| B、3:2:1 |
| C、1:1:1 |
| D、6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁是铁碳混合物,钢是纯铁、纯净物 |
| B、钢的性能不如生铁优越,使用范围不如生铁广 |
| C、生铁和钢是含碳量不同的两种铁碳的合金 |
| D、生铁和钢的主要成分都是铁,性能相近 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com