
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| n(CO2) |
| n(CO) |
|
| 1×10-14 |
| 10-9 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| n(CO2) |
| n(CO) |
| c(CO) |
| c(CO2) |
| 28×2+44 |
| 2+1 |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
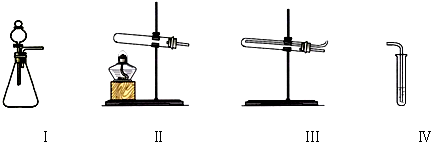
| 操作 | 现象 | |
| 甲 | 向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液.连接Ⅰ、Ⅳ,打开活塞 | Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;Ⅳ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸.连接Ⅱ、Ⅳ,点燃酒精灯 | Ⅳ中有气泡冒出,溶液变蓝 |
| 操作 | 现象 | |
| 丙 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油.使Ⅰ中发生反应将装置中空气排尽后,再将气体通入Ⅳ的溶液中 | Ⅳ中有气泡冒出,溶液不变蓝 |
| 丁 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液.依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞 | Ⅳ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、③ | C、② | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是纯天然饮品,不含任何化学物质 |
| B、它清洁、纯净,但长期饮用对健康无益 |
| C、它含有人体所需的矿物质和多种微量元素 |
| D、用催化剂可将它转化为汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -CH2CH=CH2,下列叙述中正确的是( )
-CH2CH=CH2,下列叙述中正确的是( )| A、1mol胡椒酚最多可与4molH2发生反应 |
| B、1mol胡椒酚最多可与4mol溴发生反应 |
| C、胡椒酚中所有原子可以共平面 |
| D、胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
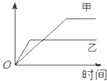 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )| 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中2NH3═N2+3H2△H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2, N2+3H2═2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3物质的量 | 2个大气压 | 10个大气压 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时增大 |
| B、同时减少 |
| C、v1增大,v2减少 |
| D、v1减少,v2增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行 |
| B、吸热反应能自发进行的原因是从外界获得了能量 |
| C、Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性 |
| D、反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com