
����Ŀ����ҵ�ϳɰ���N2��g��+3H2��g��![]() 2NH3��g�� ��H��0�����ֿ��Խ�һ���Ƹ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
2NH3��g�� ��H��0�����ֿ��Խ�һ���Ƹ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺

����68g��������������ȫ����NO��g����H2O��g�����ų�������Ϊ___________KJ��
��2���ϳɰ���Ӧ�ﵽƽ���ijʱ�̸ı�����ѡ���е�__________�������ڴﵽ��ƽ��Ĺ������淴Ӧ����ʼ������
a������ b.��С�ݻ� c������c��N2�� d��ʹ�ô���
��3��ij����С���о����������������������£��ı���ʼ�����������ʵ����Ժϳɰ���Ӧ��Ӱ�졣ʵ��������ͼ��ʾ����ͼ��T��ʾ�¶ȣ������ʾ��ʼʱH2�����ʵ����������ʾƽ��ʱNH3�����������
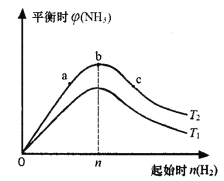
ͼ����T1��T2�Ĺ�ϵ�ǣ�T1____________T2 ������>����<������=������
�Ƚ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת����������_______________������ĸ����
���������ݻ�Ϊ1L��b���Ӧ����ʼʱn��H2��=0.30mol�����ƽ��ʱH2��ת����Ϊ60������ƽ��ʱc��N2��Ϊ_________________mo1��L-1������֪��Ӧ������ʵ�����n��H2����n��N2��=3��1Ͷ��ʱ��ƽ��ʱNH3��������������
��4��һ���¶��£���2mol N2��4mol H2����1L�ĺ����ܱ������з�Ӧ����ò�ͬ�¶���T������ͬʱ����ڹ�ҵ�ϳɰ���Ӧ��N2��ת���ʣ��õ��������±���ʾ��
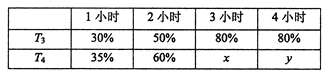
�ϱ���x��y�Ĵ�С��ϵΪx_____________y��������>����=����<�����ݡ������ܡ���
���𰸡���1��3c �C2a�C2b����2��bc����3������ �� ��c ����0.04��4��=��
��������
�����������1����N2��g����O2��g��=2NO��g������N2��g����3H2��g��=2NH3��g������2H2��g����O2��g��=2H2O��g����2������2������3�����ó�4NH3��g����5O2��g��=4NO��g����6H2O��g�� ��H=��2a��2b��3c��kJ��mol��1���������68gNH3�ų�����Ϊ��3c��2a��2b��kJ����2��a�������¶����淴Ӧ���ʶ���������������ԭ����ƽ�����淴Ӧ�����ƶ����淴Ӧ���ʽ��ͣ��ʴ���b����С���������������ѹǿ�����淴Ӧ���ʶ���������������ԭ����ƽ��������Ӧ�����ƶ����淴Ӧ����������ȷ��c����������Ũ�ȣ�ƽ��������Ӧ�����ƶ����淴Ӧ����������ȷ��d��ʹ�ô��������淴Ӧ���ʶ�����ƽ�ⲻ�ƶ����ʴ�����3����b��NH3����������ﵽ���˵���ﵽƽ�⣬�ϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�����ƶ�����T1>T2������������������Ӧ���Ũ������ƽ��������Ӧ�����ƶ�����c��N2��ת����������������������ʵ���Ϊ0.3��60%mol=0.18mol��ͬʱ����N2�����ʵ���Ϊ0.18/3mol=0.06mol����ʼʱͨ��N2�����ʵ���Ϊ0.1mol����˴ﵽƽ��ʱN2�����ʵ���Ϊ��0.1��0.06��mol=0.04mol����ʱc��N2��=0.04/1mol��L��1=0.04mol��L��1����4��T3ʱ��3Сʱ�ﵽƽ�⣬T4��ת���ʱ�T3ʱ��˵��T3���¶ȵ���T4��T4��ѧ��Ӧ���ʴ���T3�����ȴﵽƽ�⣬���x=y��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��105Pa��298K�����£�2mol����ȼ������ˮ�����ų�484kJ�����������Ȼ�ѧ����ʽ��ȷ������ ��
A. H2O��l��=H2��g��+![]() O2��g������H= +242kJ��mol-1
O2��g������H= +242kJ��mol-1
B. 2H2��g��+O2��g����2H2O��l������H= -484kJ��mol-1
C. H2��g��+![]() O2��g��=H2O��g������H= +242kJ��mol-1
O2��g��=H2O��g������H= +242kJ��mol-1
D. 2H2��g��+O2��g��=2H2O��g������H= -484kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��µ����ʵ���Ũ�ȵ�������Һ�У�pHֵ��С���ǣ� ��
A��NH4Cl B��NH4HCO3 C��NH4HSO4 D����NH4��2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��ᴿ���е���( )
A.ͨ�����ȵ�CuO��ȥH2�е�CO
B.ͨ������������Һ��ȥSO2�е�CO2
C.�μ���������������Һ��ȥNaOH��Һ��������Na2CO3
D.�μ�����NaCl��Һ��ȥKNO3��Һ��������AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڵ��۵⻯����Һ��ͨ�����������������ῴ����Һ����ɫ����Ӧ�����ӷ���ʽ��_______________��
��2���ڵ�͵����γɵ���ɫ��Һ��ͨ��SO2���壬������ɫ����ʧ����Ӧ�����ӷ���ʽ��_______________��
��3���Աȣ�1���ͣ�2��ʵ�����õĽ������Cl-��I-��SO2����ԭ����ǿ����˳������Ϊ_______________��
��4��KMnO4�������Ա�MnO2ǿ�ö࣬ʵ����Ҳ������KMnO4�����Ũ���ᷴӦ��ȡ��������Ӧ����ʽ���£�
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2��+8H2O��
�ٵ���0.2mole-ת��ʱ��������HCl��������_______________��
�������20mL12molL-1��Ũ����������KMnO4��ַ�Ӧ��ʵ�����ռ����������ڱ�״���µ������_______________��
A����1.68L B����1.68L C����1.68L D����1.68L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ȷ�Ӧ����
A. п����ϡ���ᷴӦ B. �������������Ʒ�Ӧ
C. Һ��ʯ������ȼ�� D. ʯ��ʯ���·ֽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�������ع�ҵ�У��������ʼ��ת����ϵ���£�

����˵������ȷ������ ��
A����Ӧ����III������������һ����ͬ
B���ס��ҡ������������ж����е�Ԫ��
C����Ӧ���IJ��ֲ����������������ѭ������
D����ӦV�Ļ�ѧ����ʽΪNH3+CO2+H2O+NaCl=NaHCO3��+NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H��0.ij�¶��£���2 mol SO2��1 mol O2���� 10 L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����( )
2SO3(g) ��H��0.ij�¶��£���2 mol SO2��1 mol O2���� 10 L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����( )

A.��ͼ��֪��B��SO2��ƽ��Ũ��Ϊ0.3mol��L-1
B.��ͼ��֪��A���Ӧ�¶��µ�ƽ�ⳣ��Ϊ80
C.��ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ
D.ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ����T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��

��1������84����Һ�������ʵ���Ũ��ԼΪ mol��L��1��С�������һλ����
��2��ijͬѧȡ100mL����84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c��Na+��= mol��L��1��
��3����ͬѧ���ĸ���84����Һ�����䷽������NaClO��������480mL��NaClO��������Ϊ37.25%������Һ����Ҫ����NaClO���������Ϊ g
��4������������84����Һ��ʱ������ȷ�IJ���˳���ǣ�ÿ������ֻ��һ�Σ��� ��
A��������ˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B�����ձ��м�������ˮ�ܽ�
C�����ձ��е���Һ�ز�����ע������ƿ��
D��������ƿ�ǽ����������µߵ���ҡ�ȣ�װ�����б�ǩ���Լ�ƿ
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ�İ���ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
G������ƽ����������
��5������Һ���ƹ����У����в���ʹ��ҺŨ��ƫС���ǣ� ��
A������ʱ��������ƿ�̶���
B������ƿ��ʹ��ǰδ�����������������ˮ
C������ƿ��ʹ��ǰ�ո�������һ�����ʵ���Ũ�ȵ���84����Һ����δϴ��
D������ҡ�Ⱥ���Һ���������ƿ�Ŀ̶��ߣ����ý�ͷ�ιܼ�ˮ���̶��ߣ�
E��ת����Һʱδϴ���ձ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com