
【题目】已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(l)=H2(g)+![]() O2(g);△H= +242kJ·mol-1
O2(g);△H= +242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);△H= -484kJ·mol-1
C. H2(g)+![]() O2(g)=H2O(g);△H= +242kJ·mol-1
O2(g)=H2O(g);△H= +242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);△H= -484kJ·mol-1
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. “凡造竹纸……用上好石灰化汁涂浆”,造纸利用了石灰的碱性
B. “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了置换反应
C. 三聚氰胺可用于食品添加剂
D. 含Ca(HCO3)2的硬水可通过煮沸的方法使之软化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,下列说法中错误的是
A.每生成1molFe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O32-都是还原剂
C.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将下列物质的稀溶液(浓度均为0.1mol·L-1)加热使溶液温度升高到45℃(忽略溶液体积变化),溶液的pH不变的是
A. KCl溶液 B. H2SO4溶液 C. NH4Cl溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHCO2和Na2O2按2:1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
A.只有 Na2CO3 B.NaHCO3和Na2CO3
C.NaOH和Na2CO3 D.Na2O2和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确量取10.00 mL KMnO4溶液可以选用的仪器是
A. 25 mL酸式滴定管 B. 10 mL量筒
C. 25 mL量筒 D. 25 mL碱式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa条件下,反应2N2O5 (g)=4NO2 (g)+O2(g) △H=+56.7kJ/mol能自发进行的原因( )
A.吸热反应 B.放热反应
C.熵减小的反应 D.熵增效应大于热效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C(石墨,s)=C(金刚石,s)△H>0,P(白磷,s)=P(红磷,s)△H<0。根据上述信息推论正确的是
A.前者为放热反应 B.红磷的能量比白磷低
C.红磷比金刚石稳定 D.上述变化都为物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨:N2(g)+3H2(g)![]() 2NH3(g) △H<0,氨又可以进一步制各硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) △H<0,氨又可以进一步制各硝酸,在工业上一般可进行连续生产。请回答下列问题:

若有68g氨气经催化氧化完全生成NO(g)和H2O(g)所放出的热量为___________KJ。
(2)合成氨反应达到平衡后,某时刻改变下列选项中的__________条件,在达到新平衡的过程中逆反应速率始终增大。
a.升温 b.缩小容积 c.增大c(N2) d.使用催化剂
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成氨反应的影响。实验结果如下图所示:(图中T表示温度,横轴表示起始时H2的物质的量,纵轴表示平衡时NH3的体积分数)
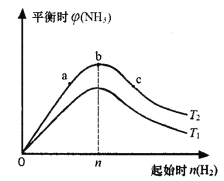
图像中T1和T2的关系是:T1____________T2 (填“>”“<”或“=”)。
比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是_______________(填字母)。
③若容器容积为1L,b点对应的起始时n(H2)=0.30mol,测得平衡时H2的转化率为60%,则平衡时c(N2)为_________________mo1·L-1。(已知反应物的物质的量按n(H2):n(N2)=3:1投料时,平衡时NH3的体积分数最大)
(4)一定温度下,将2mol N2和4mol H2置于1L的恒容密闭容器中反应,测得不同温度(T)、不同时间段内工业合成氨反应中N2的转化率,得到数据如下表所示:
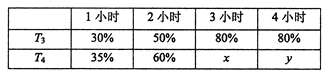
上表中x、y的大小关系为x_____________y。(填“>”“=”“<”“≥”或“≤”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com