
【题目】常用CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O↓+3H2O检验醛类。
CH3COONa+Cu2O↓+3H2O检验醛类。
(1)基态Cu2+核外电子排布式为_________。
(2)CH3COONa中碳原子轨道的杂化类型是______,1 mol CH3COONa中含有σ键的数目为_______。
(3)与OH- 离子互为等电子体的阴离子为________。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为_________。
(5)Cu2O 晶体结构可能是________(填字母)。

【答案】 1s22s22p63s23p63d9 sp3 sp2 6NA HS- 乙酸钠是离子晶体,乙酸、乙醛是分子晶体,所以乙酸钠的沸点最高,乙酸分子间含有氢键,所以乙酸的沸点大于乙醛; A
【解析】试题(1)Cu2+核外有27个电子;(2)CH3COONa中甲基上的碳原子为单键碳,羧基上的碳原子有1个碳氧双键;共价单键是σ键,双键中有1个σ键、1个π键;(3)等离子体是原子数相同、价电子数相同的微粒;乙酸钠是离子晶体,乙酸、乙醛是分子晶体,乙酸分子间含有氢键;(5)Cu2O属于离子晶体,A中原子个数比是1:2,B中原子个数比是1:1。
解析:(1)Cu2+核外有27个电子,根据能量最低原理,基态Cu2+核外电子排布式为1s22s22p63s23p63d9;(2)CH3COONa中甲基上的碳原子为单键碳,该碳原子为sp3杂化,羧基上的碳原子有1个碳氧双键,该碳原子为sp2杂化;共价单键是σ键,双键中有1个σ键、1个π键,CH3COONa中含有5个单键和一个碳氧双键,所以1 mol CH3COONa中含有σ键的数目为6NA;(3)等离子体是原子数相同、价电子数相同的微粒,与OH- 离子互为等电子体的阴离子为HS-;乙酸钠是离子晶体,乙酸、乙醛是分子晶体,所以乙酸钠的沸点最高,乙酸分子间含有氢键,所以乙酸的沸点大于乙醛;(5)Cu2O属于离子晶体,A中原子个数比是1:2,B中原子个数比是1:1,所以Cu2O 晶体结构可能是A。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,由相同种类元素组成的是 ( )
A.胆固醇、脂肪酸、脂肪酶 B.淀粉、半乳糖、糖原
C.氨基酸、核苷酸、麦芽糖 D.性激素、脱氧核糖、胰岛素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室将NH4Cl和Ca(OH)2各0.1mol固体混合共热,反应后的残渣溶于足量的蒸馏水中,得到的溶液中氨和Ca(OH)2皆为0.05mol (假设没有氨气逸出),在溶液中滴加一定浓度的盐酸,若Ca(OH)2为强碱,下列说法正确的是
A. n(HCl)=0.1mol,c(H+)+c(NH4+)>c(OH-)
B. n(HCl)=0.15mol,2c(H+)+2c(NH4+)=c(Ca2+)+2c(OH-)
C. n(HCl)=0.20mol,c(H+)+c(NH4+)=c(Ca2+)+c(OH-)
D. 残渣的组成为:n[(Ca(OH)2]=0.05 mol,n(CaCl2)=0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以化合物A为原料合成化合物M的线路如下图所示。

(1)写出化合物B中含氧官能团的名称为________________。
(2)①的反应类型为________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_____________。
①能与FeCl3发生显色反应; ②分子中有3种不同化学环境的氢;
(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式__________________。
(5)以苯酚、乙醇、![]() 为有机原料合成
为有机原料合成 ,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol葡萄糖可水解生成2mol乳酸(C3H6O3)
B.顺﹣2﹣丁烯和反﹣2﹣丁烯的加氢产物不同
C.![]() nOH的结构中含有酯基
nOH的结构中含有酯基
D.油脂和蛋白质都是能发生水解反应的高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料.添加塑化剂(DBP为邻苯二甲酸二丁酯)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害.其合成线路图如图I所示:
已知以下信息:
① ![]()
![]()
![]()
②R1CHO+R2CH2CHO ![]()
![]() (﹣R1、R2表示氢原子或烃基)
(﹣R1、R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧衍生物,
其核磁共振氢谱图如图II所示
请根据以上信息回答下列问题:
(1)A的结构简式为 , C的结构简式为 ,
(2)E中所含官能团的名称是、 .
(3)同时符合下列条件的B的同分异构体有种,写出其中任意两种同分异构体的结构简式、 .
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
(4)写出由C生成D的化学反应方程式 .
(5)写出由B与F反应生成DBP的化学反应方程式 , 反应类型是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用.
(1)工业上冶炼铝的化学方程式是 .
(2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3 , 则负极反应式为 .
(3)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护. 
在相同条件下,三组装置中铁电极腐蚀最快的是(填序号),为防止金属Fe被腐蚀,可以采用上述(填序号)装置原理进行防护.
(4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,据此回答:则该电源电极Y名称为 , 流过导线的电子物质的量是 , A池中碳棒上的电极反应式是 , B池中粗铜电极上存在的电极反应式是 , C池中一段时间后硝酸银溶液浓度(填增大,减小或不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法正确的是

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池工作时,H+向锌筒移动
C. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
D. 酸性氢氧燃料电池的正极反应式为O2 + 4H+ + 4e-= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 .
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=mol/L.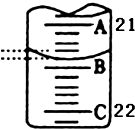
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com