
°ĺŐ‚ńŅ°ŅŐķ°Ę¬Ńľį∆šĽĮļŌőÔ‘ŕ…ķ≤ķļÕ…ķĽÓ÷–”–◊ŇĻ„∑ļĶń”¶”√£ģ
£®1£©Ļ§“Ķ…Ō“ĪŃ∂¬ŃĶńĽĮ—ß∑Ĺ≥Ő Ĺ « £ģ
£®2£©ő“Ļķ ◊īīĶńļ£—ůĶÁ≥ō“‘¬ŃįŚő™łļľę£¨≤¨ÕÝő™’żľę£¨ļ£ňģő™ĶÁĹ‚÷ »‹“ļ£¨Ņ’∆Ý÷–Ķń—ű∆Ý”Ž¬Ń∑ī”¶≤ķ…ķĶÁŃų£ģĶÁ≥ō◊‹∑ī”¶ő™4Al+3O2+6H2O®T4Al£®OH£©3 £¨ ‘Úłļľę∑ī”¶ Ĺő™ £ģ
£®3£©ń≥—–ĺŅ–‘—ßŌį–°◊ť…Ťľ∆Ńň»ÁÕľ1ňý ĺ◊į÷√ŐĹĺŅł÷ŐķĶńłĮ ī”Ž∑ņĽ§£ģ 
‘ŕŌŗÕ¨ŐűľĢŌ¬£¨»ż◊ť◊į÷√÷–ŐķĶÁľęłĮ ī◊ÓŅžĶń «£®ŐÓ–ÚļŇ£©£¨ő™∑ņ÷ĻĹū ŰFeĪĽłĮ ī£¨Ņ…“‘≤…”√…Ō Ų£®ŐÓ–ÚļŇ£©◊į÷√‘≠ņŪĹÝ––∑ņĽ§£ģ
£®4£©»ÁÕľ2ňý ĺ£¨»ŰĶÁĹ‚5min ĪC≥ō÷–ŐķįŰ÷ ŃŅ‘Ųľ”2.16g£¨ĺ›īňĽōīū£ļ‘Úł√ĶÁ‘īĶÁľęY√Ż≥∆ő™ £¨ ŃųĻżĶľŌŖĶńĶÁ◊”őÔ÷ ĶńŃŅ « £¨ A≥ō÷–ŐľįŰ…ŌĶńĶÁľę∑ī”¶ Ĺ « £¨ B≥ō÷–ī÷Õ≠ĶÁľę…Ōīś‘ŕĶńĶÁľę∑ī”¶ Ĺ « £¨ C≥ō÷–“Ľ∂ő ĪľšļůŌűňŠ“Ý»‹“ļŇ®∂»£®ŐÓ‘Ųīů£¨ľű–°ĽÚ≤ĽĪš£©£ģ
°ĺīūįł°Ņ
£®1£©2Al2O3 ![]() 4Al+3O2°Ł
4Al+3O2°Ł
£®2£©Al©Ā3e©Ā=Al3+
£®3£©ĘŔ£ĽĘŕĘŘ
£®4£©łļľę£Ľ0.02mol£Ľ2Cl©Ā©Ā2e©Ā=Cl2°Ł£Ľ Cu©Ā2e©Ā=Cu2+£Ľ≤ĽĪš
°ĺĹ‚őŲ°ŅĹ‚£ļ£®1£©Ļ§“Ķ…Ō“ĪŃ∂¬ŃĶńĽĮ—ß∑Ĺ≥Ő Ĺ «£ļ2Al2O3 ![]() 4Al+3O2°Ł£¨
4Al+3O2°Ł£¨
ňý“‘īūįł «£ļ2Al2O3 ![]() 4Al+3O2°Ł£Ľ£®2£©ő“Ļķ ◊īīĶńļ£—ůĶÁ≥ō“‘¬ŃįŚő™łļľę£¨≤¨ÕÝő™’żľę£¨ļ£ňģő™ĶÁĹ‚÷ »‹“ļ£¨Ņ’∆Ý÷–Ķń—ű∆Ý”Ž¬Ń∑ī”¶≤ķ…ķĶÁŃų£ģĶÁ≥ō◊‹∑ī”¶ő™4Al+3O2+6H2O®T4Al£®OH£©3£¨¬Ń◊Ųłļľę ßĶÁ◊”ĪĽ—űĽĮ£¨‘Úłļľę∑ī”¶ Ĺő™£ļAl©Ā3e©Ā=Al3+£¨
4Al+3O2°Ł£Ľ£®2£©ő“Ļķ ◊īīĶńļ£—ůĶÁ≥ō“‘¬ŃįŚő™łļľę£¨≤¨ÕÝő™’żľę£¨ļ£ňģő™ĶÁĹ‚÷ »‹“ļ£¨Ņ’∆Ý÷–Ķń—ű∆Ý”Ž¬Ń∑ī”¶≤ķ…ķĶÁŃų£ģĶÁ≥ō◊‹∑ī”¶ő™4Al+3O2+6H2O®T4Al£®OH£©3£¨¬Ń◊Ųłļľę ßĶÁ◊”ĪĽ—űĽĮ£¨‘Úłļľę∑ī”¶ Ĺő™£ļAl©Ā3e©Ā=Al3+£¨
ňý“‘īūįł «£ļAl©Ā3e©Ā=Al3+£Ľ£®3£©ĘŔ◊į÷√ő™‘≠ĶÁ≥ōŐķő™łļľęĪĽłĮ ī£ĽĘŕ◊į÷√ő™‘≠ĶÁ≥ō–Ņ◊ŲłļľęĪĽłĮ ī£¨Őķ◊Ų’żľęĪĽĪ£Ľ§£ĽĘŘ◊į÷√ő™ĶÁĹ‚≥ō£¨Őķ◊Ų“űľęĪĽĪ£Ľ§£ĽĘŔ◊ť◊į÷√÷–ŐķĶÁľęłĮ ī◊ÓŅž£¨’żľę∑ī”¶ «—ű∆ÝĶ√ĶĹĶÁ◊”∑Ę…ķĽĻ‘≠∑ī”¶£¨ĶÁľę∑ī”¶ő™£ļO2+2H2O+4e©Ā=4OH©Ā£ĽĘŕ÷–łļľę…ŌĹū Ű–Ņ ßĶÁ◊”£¨ĶÁľę∑ī”¶ő™£ļZn©Ā2e©Ā=Zn2+£¨Ĺū ŰŐķĪĽĪ£Ľ§£¨īň ĪĹū ŰŐķŅ…“‘≤…őĢ…Ł—ŰľęĶń“űľęĪ£Ľ§∑®£¨◊į÷√ĘŘ÷–∑Ę…ķĶń «ĶÁĹ‚Ī•ļÕ ≥—őňģĶń∑ī”¶£¨—Űľę «¬»ņŽ◊” ßĶÁ◊”…ķ≥…¬»∆Ý£¨“űľę ««‚ņŽ◊”Ķ√ĶĹĶÁ◊”∑Ę…ķĽĻ‘≠∑ī”¶£¨“űľęŐķĪĽĪ£Ľ§£¨
ňý“‘īūįł «£ļĘŔ£ĽĘŕĘŘ£Ľ£®4£©»ÁÕľ2ňý ĺ£¨»ŰĶÁĹ‚5min ĪC≥ō÷–ŐķįŰ÷ ŃŅ‘Ųľ”2.16g£¨‘ÚC÷–ŐķįŰő™“űľę£¨ĶÁľę∑ī”¶ő™£ļAg++e©Ā=Ag£¨‘ŲīůĶń÷ ŃŅő™őŲ≥Ų“ÝĶń÷ ŃŅ£¨őÔ÷ ĶńŃŅ= ![]() =0.02mol£¨ĶÁ◊”◊™“∆◊‹őÔ÷ ĶńŃŅő™0.02mol£¨AgĶÁľęő™—Űľę£¨ĶÁľę∑ī”¶ő™£ļAg©Āe©Ā=Ag+£¨C≥ōő™ĶÁ∂∆≥ōĶÁĹ‚÷ »‹“ļ÷–»‹÷ Ň®∂»≤ĽĪš£¨∑÷őŲŇ–∂Ō£¨B◊į÷√÷–“ņīőīŅÕ≠◊Ų“űľę£¨ĶÁľę∑ī”¶ő™Cu2++2e©Ā=Cu£¨ī÷Õ≠◊Ų—Űľę£¨ĶÁľę∑ī”¶ő™Cu©Ā2e©Ā=Cu2+£¨A◊į÷√÷–ŐķįŰ◊Ų“űľę£¨ĶÁľę∑ī”¶ő™£ļ2H++2e©Ā=H2°Ł£¨ŐľįŰ◊Ų—Űľę£¨ĶÁľę∑ī”¶ő™£ļ2Cl©Ā©Ā2e©Ā=Cl2°Ł£¨Xő™’żľę£¨Yő™łļľę£¨
=0.02mol£¨ĶÁ◊”◊™“∆◊‹őÔ÷ ĶńŃŅő™0.02mol£¨AgĶÁľęő™—Űľę£¨ĶÁľę∑ī”¶ő™£ļAg©Āe©Ā=Ag+£¨C≥ōő™ĶÁ∂∆≥ōĶÁĹ‚÷ »‹“ļ÷–»‹÷ Ň®∂»≤ĽĪš£¨∑÷őŲŇ–∂Ō£¨B◊į÷√÷–“ņīőīŅÕ≠◊Ų“űľę£¨ĶÁľę∑ī”¶ő™Cu2++2e©Ā=Cu£¨ī÷Õ≠◊Ų—Űľę£¨ĶÁľę∑ī”¶ő™Cu©Ā2e©Ā=Cu2+£¨A◊į÷√÷–ŐķįŰ◊Ų“űľę£¨ĶÁľę∑ī”¶ő™£ļ2H++2e©Ā=H2°Ł£¨ŐľįŰ◊Ų—Űľę£¨ĶÁľę∑ī”¶ő™£ļ2Cl©Ā©Ā2e©Ā=Cl2°Ł£¨Xő™’żľę£¨Yő™łļľę£¨
ňý“‘īūįł «£ļłļľę£Ľ 0.02mol£Ľ 2Cl©Ā©Ā2e©Ā=Cl2°Ł£ĽCu©Ā2e©Ā=Cu2+£Ľ≤ĽĪš£ģ



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥–©ĽĮ—ßő Ő‚Ņ…”√Ōŗň∆Ķń ĺ“‚ÕľņīĪŪ ĺ°£Ō¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «

—°ŌÓ | ļŠ◊ÝĪÍ | ◊›◊ÝĪÍ | —–ĺŅ∂‘Ōů |
A | ∑ī”¶Ļż≥Ő | ń‹ŃŅ | NH4ClļÕBa(OH)2 °§8H2O∑ī”¶ |
B | ∑ī”¶ő¬∂» | ∑ī”¶ňŔ¬ | √łīŖĽĮ∑ī”¶ |
C | HCl»‹“ļŐŚĽż | ≥ŃĶŪ÷ ŃŅ | 0.1 mol°§L£≠1—őňŠĶőľ”ĶĹÕ¨Ň®∂»AgNO3»‹“ļ÷– |
D | ∑ī”¶ Īľš | »‹“ļő¬∂» | ◊„ŃŅőīīÚń•Ķń√ĺŐű∑Ň‘ŕ1mol°§L£≠1H2SO4»‹“ļ÷– |
A. A B. B C. C D. D
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥»‹“ļ÷–Ņ…ń‹ļ¨”–OH-°ĘCO32-°ĘA1O2-°ĘSiO32-°ĘSO42-°ĘHCO3-°ĘNa+°ĘFe3+°ĘMg2+°ĘAl3+Ķ»ņŽ◊”°£ĶĪŌÚł√»‹“ļ÷–÷ūĶőľ”»Ž“Ľ∂®őÔ÷ ĶńŃŅŇ®∂»Ķń—őňŠ»‹“ļ Ī£¨∑ĘŌ÷…ķ≥…≥ŃĶŪĶńőÔ÷ ĶńŃŅňś—őňŠ»‹“ļĶńŐŚĽżĪšĽĮ»ÁŌ¬Õľňý ĺ°£Ō¬Ń–ňĶ∑®’ż»∑Ķń «
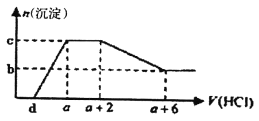
A. ‘≠»‹“ļ÷–Ņ…ń‹ļ¨”–Na2SO4°ĘŅ…ń‹≤Ľļ¨”–CO32-
B. ‘≠»‹“ļ÷–“Ľ∂®ļ¨”–Ķń“űņŽ◊”÷Ľ”–:OH-°ĘA1O2-°ĘCO32-
C. ‘≠»‹“ļ÷–ļ¨CO32-”ŽA1O2-ĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™3:4
D. a-d>3/4
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ≥£”√CH3CHO+NaOH+2Cu(OH)2![]() CH3COONa+Cu2O°ż+3H2Oľž—ť»©ņŗ°£
CH3COONa+Cu2O°ż+3H2Oľž—ť»©ņŗ°£
£®1£©ĽýŐ¨Cu2+ļňÕ‚ĶÁ◊”ŇŇ≤ľ Ĺő™_________°£
£®2£©CH3COONa÷–Őľ‘≠◊”ĻžĶņĶń‘”ĽĮņŗ–Õ «______£¨1 mol CH3COONa÷–ļ¨”–¶“ľŁĶń żńŅő™_______°£
£®3£©”ŽOH£≠ ņŽ◊”Ľ•ő™Ķ»ĶÁ◊”ŐŚĶń“űņŽ◊”ő™________°£
£®4£©∑–Ķ„łŖĶÕ£ļ““ňŠń∆£ĺ““ňŠ£ĺ““»©£¨’‚ «“Úő™_________°£
£®5£©Cu2O ĺßŐŚĹŠĻĻŅ…ń‹ «________£®ŐÓ◊÷ńł£©°£

≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™Ō©ŐĢ”ŽĪĹ‘ŕ“Ľ∂®ŐűľĢŌ¬∑ī”¶…ķ≥…∑ľŌ„ŐĢ£ģ»Á£ļ![]() +H2C®TCH2
+H2C®TCH2 ![]()
![]()
![]() +2H2C®TCH2
+2H2C®TCH2 ![]()
![]()
![]() +2H2C®TCH2
+2H2C®TCH2 ![]()
![]()
ĪŻŌ© «»żīůļŌ≥…≤ńŃŌĶńĽýĪĺ‘≠ŃŌ£¨Ņ…”√”ŕļŌ≥…”¶”√Ļ„∑ļĶńDAP ų÷¨Ķ•ŐŚļÕňę∑”Ķ»”–ĽķőÔ£¨ĺŖ”–÷ō“™ĶńĻ§“Ķ”√Õĺ£ģ
£®1£©–ī≥ŲĪŻŌ©‘ŕ“Ľ∂®ŐűľĢŌ¬∑Ę…ķĺŘļŌ∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺ £ģ
£®2£©ĪŻŌ©‘ŕ““ňŠ◊ų”√Ō¬”ŽO2∑ī”¶…ķ≥…”–ĽķőÔA£¨∆š’Ű∆Ý√‹∂» «ŌŗÕ¨◊īŅŲŌ¬ľ◊Õť√‹∂»Ķń6.25Ī∂£¨‘™ňōĶń÷ ŃŅ∑÷ żő™£ļŐľ60%°Ę—ű32%£ģAĶń∑÷◊” Ĺő™ £ģ
£®3£©ĪŻŌ©”ŽĪĹ‘ŕ“Ľ∂®ŐűľĢŌ¬∑ī”¶Ņ……ķ≥…M°ĘNĶ»∂ŗ÷÷∑ľŌ„ŐĢ£ģļžÕ‚Ļ‚∆◊°ĘļňīŇĻ≤’Ů «—–ĺŅ”–ĽķőÔĹŠĻĻĶń÷ō“™∑Ĺ∑®£¨łýĺ›Ō¬Ń– żĺ›£¨–ī≥ŲM°ĘNĶńĹŠĻĻľÚ Ĺ£ģ
M£ļ‘™ňō◊ť≥…£ļC 89.99%°ĘH 10.06%£Ľ1HļňīŇĻ≤’Ů”–5łŲ–ŇļŇ£ģ
N£ļ‘™ňō◊ť≥…£ļC 88.82%°ĘH 11.18%£Ľ1HļňīŇĻ≤’Ů”–3łŲ–ŇļŇ£ģ
M£ļ £ģ N£ļ £ģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–≤ĽÕ¨ņŗĪūőÔ÷ ÷–ĺýļ¨”–C°ĘH°ĘO»ż÷÷‘™ňōĶń «£®°°°°£©
A.īľ
B.ÕťŐĢ
C.Ő«ņŗ
D.”Õ÷¨
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ“—÷™≤›ňŠő™∂Ģ‘™»űňŠ£ļ
H2C2O4![]() HC2O4£≠+H+ Ka1
HC2O4£≠+H+ Ka1
HC2O4£≠![]() C2O42£≠+H+ Ka2
C2O42£≠+H+ Ka2
≥£ő¬Ō¬£¨ŌÚń≥Ň®∂»Ķń≤›ňŠ»‹“ļ÷–÷ūĶőľ”»Ž“Ľ∂®ŃŅŇ®∂»ĶńKOH»‹“ļ£¨ňýĶ√»‹“ļ÷–H2C2O4°ĘHC2O4£≠°ĘC2O42£≠»ż÷÷őĘŃ£ĶńőÔ÷ ĶńŃŅ∑÷ ż£®¶ń£©”Ž»‹“ļpHĶńĻōŌĶ»ÁÕľňý ĺ£¨‘ÚŌ¬Ń–ňĶ∑®÷–≤Ľ’ż»∑Ķń «

A£ģpH=1.2»‹“ļ÷–£ļc(K+) + c(H+) = c(OH£≠) + c(H2C2O4)
B£ģpH=2.7»‹“ļ÷–£ļc2(HC2O4£≠) / [c(H2C2O4) °Ń c(C2O42£≠)]=1000
C£ģĹęŌŗÕ¨őÔ÷ ĶńŃŅKHC2O4ļÕK2C2O4ĻŐŐŚÕͻ껋”ŕňģŅ…ŇšĶ√pHő™4.2ĶńĽžļŌ“ļ
D£ģŌÚpH=1.2Ķń»‹“ļ÷–ľ”KOH»‹“ļĹępH‘Ųīů÷Ń4.2ĶńĻż≥Ő÷–ňģĶńĶÁņŽ∂»“Ľ÷Ī‘Ųīů
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņļ»ĺ’Ľ®≤Ť Ī£¨»ň√«ÕýÕýŌ≤Ľ∂ľ”…ŌľłŅŇĪýŐ«£¨ĪýŐ«”–…ķĹÚ»ů∑ő°Ę÷ĻŅ»ĽĮŐĶĶ»Ļ¶–ߣ¨ĪýŐ«Ķń÷ų“™≥…∑÷ «£® £©
A£ģ∆ŌŐ—Ő« B£ģ’ŠŐ« C£ģ¬ů—ŅŐ« D£ģ»ťŐ«
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņň◊≥∆°į“ĽĶőŌ„°ĪĶń”–∂ĺőÔ÷ ĪĽ»ň ≥”√ļůĽŠňū…ňłő‘ŗ£¨ĽĻń‹÷¬į©°£°į“ĽĶőŌ„°ĪĶń∑÷◊”ĹŠĻĻ»ÁÕľňý ĺ£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «

A. ł√”–ĽķőÔ∑÷◊” Ĺő™£ļC7H10O3
B. ł√”–ĽķőÔňý”–÷ ◊”Ņ…ń‹‘ŕÕ¨°™∆Ĺ√ś
C. ł√”–ĽķőÔń‹∑Ę…ķ»°īķ°Ęľ”≥…°Ę—űĽĮ°ĘĽĻ‘≠∑ī”¶
D. ł√”–ĽķőÔĶń“Ľ÷÷ļ¨ĪĹĽ∑ĶńÕ¨∑÷“žĻĻŐŚń‹∑Ę…ķ“ÝĺĶ∑ī”¶
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com