
【题目】已知草酸为二元弱酸:
H2C2O4![]() HC2O4-+H+ Ka1
HC2O4-+H+ Ka1
HC2O4-![]() C2O42-+H+ Ka2
C2O42-+H+ Ka2
常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A.pH=1.2溶液中:c(K+) + c(H+) = c(OH-) + c(H2C2O4)
B.pH=2.7溶液中:c2(HC2O4-) / [c(H2C2O4) × c(C2O42-)]=1000
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大
【答案】C
【解析】
试题分析:A、pH=1.2溶液中,电荷守恒:c(K+)+c(H+)=c(OH-)+c(HC2O4-),从图分析c(HC2O4-)=c(H2C2O4),所以有c(K+)+c(H+)=c(OH-)+c(H2C2O4),正确,不选A;B、根据电离平衡常数分析,K1=c(H+)c(HC2O4-)/c(H2C2O4)=10-1.2,K2=c(H+)c(C2O42-)/c(HC2O4-)=10-4.2,K1/K2=c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=10-1.2/10-4.2=1000,所以不选B;C、在pH=4.2时,c(C2O42-)=c(HC2O4-),溶液显酸性,说明草酸氢根的电离大于水解,所以当加入的草酸氢钾和草酸钾等物质的量加入时,电离大于水解后,二者的浓度不再相等,所以不可能配成pH=4.2的溶液,选C;D、从pH=1.2变到pH=4.2,溶液的酸性减弱,对水的电离抑制作用减弱,所以水的电离程度一直增大,不选D。


科目:高中化学 来源: 题型:
【题目】下列关于“焰色反应”的理解和应用不正确的是
A.可用光洁无锈的铁丝替代铂丝作焰色反应实验
B.实验完成后铂丝用盐酸洗净,在外焰上灼烧至没有颜色时再使用
C.只有某些金属或其化合物才有焰色反应
D.用焰色反应鉴别NaCl、KCl和K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.铁粉溶于浓盐酸:Fe+2H+=Fe2++H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.小苏打溶液中加入盐酸:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)中学实验常用如图所示装置制取少量溴苯。在烧瓶a中装的试剂是苯、溴和铁粉。请填写下列空白。
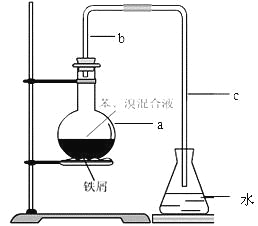
⑴导管b的作用有两个:一是导气,二是兼起 的作用;
⑵a中反应的化学方程式为 ;
⑶该实验得到的是粗苯,为了除去其中的溴,要用到的一种常用除杂操作方法是 ,提纯溴苯的具体步骤有:
①蒸馏;②水洗;③用干燥剂干燥;④10%NaOH溶液洗;⑤水洗 。
正确的操作顺序为( )
A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |
⑷为证明苯和溴发生的是取代反应而不是加成反应,可向水中加入 ;但该实验不够严密,为此必须在导管a、b之间加上一盛有 的洗气瓶,目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可行的是( )
A. 用食醋除去热水瓶中的水垢
B. 用米汤检验加碘盐中的碘酸钾(KIO3)
C. 向Al2(SO4)3溶液中加过量NaOH溶液,制Al(OH)3
D. 向稀H2SO4催化水解后的麦芽糖溶液中直接加入新制Cu(OH)2悬浊液,检验水解产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种白色粉末,溶于水形成的溶液呈弱酸性。过氧化尿素不稳定,在痕量重金属离子等活性催化剂的存在下迅速分解。工业生产过氧化尿素的原理和流程如下。
原理:CO(NH2)2+H2O2 ![]() CO(NH2)2·H2O2
CO(NH2)2·H2O2
流程:
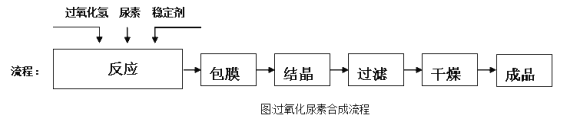
回答下列问题:
(l)已知过氧化尿素[CO(NH2)2·H2O2]中的CO(NH2)2与H2O2以氢键连接,其中碳元素的化合价是___________。(填序号)
A. +2价 B. -l价 C. 0价 D. +4价
(2)过氧化尿素鉴定反应:在重铬酸钾酸性溶液中加入乙醚和少许过氧化尿素,振荡。上层乙醚呈蓝色,这是由于在酸性溶液中过氧化尿素中的过氧化氢与重铬酸钾反应生成较稳定的蓝色过氧化铬(CrO5)。写出H2O2与重铬酸钾反应的离子方程式__________。
(3)经过上述化学工艺后的产品是粗产品。已知30℃时尿素的溶解度远大于过氧化尿素的溶解度,则提纯粗产品的操作顺序是___________ (填序号)。
①冷却至30℃结晶 ②过滤 ③蒸发浓缩 ④溶解 ⑤洗涤
(4)在实验室中采用上述原理制取过氧化尿素,搅拌器的材质一般用玻璃而非铁质,原因是___。
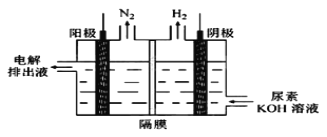
(5)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________。
(6)Ⅰ.为测定产品中H2O2的含量,常用KMnO4溶液滴定H2O2,高锰酸钾标准溶液通常放置时间较长,因此在滴定H2O2前,常用现配的草酸钠溶液先标定出KMnO4标准溶液的浓度。
Ⅱ.称取过氧化尿素样品4.000g ,溶解在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1.00mL 6mo1/L的硫酸,用标定过的0.2000mol/L的高锰酸钾标准溶液滴定至滴入最后一滴时溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4标准溶液10.00mL,(KMnO4与尿素不反应)。
①H2O2的质量分数是_______ (精确至0.1%)。
②若装草酸钠溶液的滴定管水洗后未润洗,最终H2O2的质量分数______ (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见有机物转化关系(部分相关物质和反应条件已略去)

已知:Ⅰ. C的相对分子质量为60,且分子中碳元素的质量分数为40% 。
Ⅱ.B、 C、D分子含碳原子个数相同;E为高分子化合物。
回答下列问题:
(1)B中含有的官能团名称为 。
(2)E中链节为 。
(3)写出反应①的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com