
【题目】下列说法正确的是
A.pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-6molL-1
B.浓度均为0.1 molL-1的CuSO4和(NH4)2SO4的混合溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)
C.0.1 molL-1NaF溶液中加入NH4Cl至中性:c(HF)=c(NH3H2O)
D.0.100 molL-1的Na2S溶液中通入HCl气体,至c(Cl-)=0.100 molL-1(忽略溶液体积的变化及H2S的挥发):c(OH-)-c(H+)=c(HS-)-c(S2-)
【答案】C
【解析】
A. pH=6的NaHSO3溶液中氢离子的浓度为10-6molL-1 ,氢氧根离子的浓度为10-8molL-1 ,根据电荷守恒得:c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),根据物料守恒得:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),两式联立得:c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=10-6molL-1-10-8molL-1=9.9×10-7molL-1,A项错误;
B. NH4+和Cu2+水解,使溶液均显酸性,但水解程度不大,硫酸根离子不会水解,浓度均为![]() 的CuSO4和(NH4)2SO4的混合溶液中:c(SO42-) > c(NH4+) >c(Cu2+)>c(H+),B项错误;
的CuSO4和(NH4)2SO4的混合溶液中:c(SO42-) > c(NH4+) >c(Cu2+)>c(H+),B项错误;
C.根据电荷守恒有:c(H+)+c(NH4+)+c(Na+)=c(F-)+c(Cl-)+c(OH-),溶液显中性,c(H+)= c(OH-),所以c(NH4+)+c(Na+)=c(F-)+c(Cl-),根据物料守恒有:c(Cl-)=c(NH3H2O)+c(NH4+),c(Na+)=c(F-)+c(HF),因此有c(HF)=c(NH3H2O),C项正确;
D. c(Cl-)=0.100 molL-1的溶液中,c(S2-)+c(HS-)+c(H2S)=c(Cl-)=0.100 molL-1,又因c(Cl-)+c(OH-)=c(H+)+c(HS-)+2c(H2S),所以c(OH-)-c(H+)=c(HS-)+2c(H2S)-[ c(S2-)+c(HS-)+c(H2S)]=c(H2S)-c(S2-),D项错误;
答案选C。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断( )
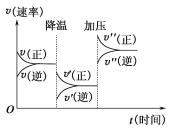
A.温度越高,该反应的化学平衡常数越大B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实,不能用勒夏特列原理解释的是 ( )
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO当加入NaOH溶液后颜色变浅
HBr+HBrO当加入NaOH溶液后颜色变浅
B. 对![]()
![]()
![]() 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C. 反应![]()
![]() CO2+NO△H<0升高温度使平衡向逆方向移动
CO2+NO△H<0升高温度使平衡向逆方向移动
D. 合成氨反应:![]()
![]() 2NH3,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
2NH3,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是 ![]()
![]()
A.0.1molL-1KClO溶液中ClO-的数目小于0.1NA
B.25℃时,100mlpH=8的氨水中NH4+的个数为9.9×10-8NA
C.34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA
D.0.3molAgNO3受热完全分解![]() ,用排水法收集到气体的分子数为0.25NA
,用排水法收集到气体的分子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列说法正确的是( )
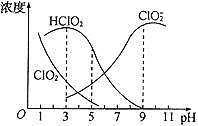
A.亚氯酸钠在酸性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10-6
C.pH越大,该漂白剂的漂白性能越好
D.25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
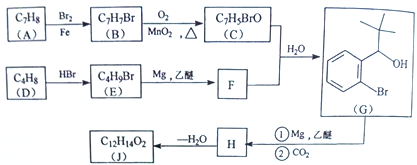
己知: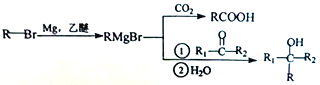
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了缓解温空效应,科学家提出了多种回收和利用![]() 的方案。
的方案。
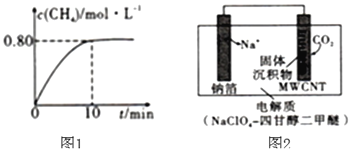
![]() 方案1:利用FeO吸收
方案1:利用FeO吸收![]() 获得
获得![]()
![]()
![]()
则![]() ______。
______。
方案2:利用![]() 制备
制备![]()
![]() 时,向2L恒容密闭容器中充入
时,向2L恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,混合气体中
,混合气体中![]() 的浓度与反应时间的关系如图1所示。
的浓度与反应时间的关系如图1所示。
![]() ①从反应开始到恰好达到平衡时,
①从反应开始到恰好达到平衡时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。
②![]() 时,反应的平衡常数
时,反应的平衡常数![]() ______。
______。
③保持温度不变,向平衡后的容器中再充入![]() 和
和![]() ,重新达到平衡时
,重新达到平衡时![]() 的浓度______
的浓度______![]() 填序号
填序号![]() 。
。
A.等于![]()
![]() 等于
等于![]()
![]()
![]() 大于
大于![]()
![]() 时,如果该容器中有
时,如果该容器中有![]() 、
、![]() 、
、![]() 、
、![]() 。则
。则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() “
“![]() 。
。
![]() 已知:
已知:![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() 则
则![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
方案3:利用“![]() ”电池将
”电池将![]() 变废为宝。我国科研人员研制出的可充电“
变废为宝。我国科研人员研制出的可充电“![]() ”电池以钠箔和多壁碳纳米管
”电池以钠箔和多壁碳纳米管![]() 为电极材料,总反应为
为电极材料,总反应为![]()
![]()
![]() 放电时该电池“吸入”
放电时该电池“吸入”![]() ,其工作原理如图2所示:
,其工作原理如图2所示:![]() 假设开始时两极的质量相等
假设开始时两极的质量相等![]()
![]() ①放电时,正极的电极反应式为______。
①放电时,正极的电极反应式为______。
②若生成的![]() 和C全部沉积在电极表面,当转移
和C全部沉积在电极表面,当转移![]() 时,两极的质量差为______g。
时,两极的质量差为______g。
![]() 室温下,物质的量浓度均为
室温下,物质的量浓度均为![]() 的几种含碳盐溶液的pH如下表:
的几种含碳盐溶液的pH如下表:
序号 | ① | ② | ③ |
溶液 |
| NaX |
|
pH |
|
|
|
写出溶液②中通入少量![]() 的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
的离子方程式:______;等体积的①和③形成的混合溶液中离子浓度由大到小排列为:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A. 该生物燃料电池不可以在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 消耗1 mol氧气时转移4 mol e-,H+向负极移动
D. 今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃X在标准状况下的密度为1.16 g·L-1,D能发生银镜反应,E为聚氯乙烯,有关物质的转化关系如下图,请回答下列问题。

(1)反应②的反应类型为________,一定条件下X能发生类似于⑤的反应,所得高分子化合物的结构简式为
_________________。
(2)A与F在催化剂作用下直接生成G的化学方程式为
_______________________________________________________________________________。
(3)下列说法正确的是________。
A.A、B、E均能使酸性高锰酸钾溶液褪色
B.G的同分异构体中能与碳酸氢钠反应生成CO2气体的物质有4种
C.F、G都能与NaOH溶液反应,且都生成钠盐
D.X先后与F、H2反应也可以制得G
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com