
【题目】下列5种烃:①2-甲基丁烷、②2,2-二甲基丙烷、③丙烷、④戊烷、⑤2-甲基丙烷,其沸点按由高到低的顺序排列正确的是( )
A. ①②③④⑤B. ②③④⑤①
C. ⑤②①③④D. ④①②⑤③
科目:高中化学 来源: 题型:
【题目】利用下图进行实验,装置丙中实验现象正确的是

选项 | 装置甲 | 装置乙 | 装置丙 | 装置丙中的实验现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾试液 | 溶液变为蓝色 |
C | 浓氨水 | 氧化钙 | 硝酸银溶液 | 先有沉淀生成,后沉淀消失 |
D | 稀硫酸 | 碳酸钠 | 饱和碳酸钠溶液 | 先有沉淀生成,后沉淀消失 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金),为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误:
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)掌握物质之间的转化,是学习元素化合物知识的基础。
(1)中学常见的某有色物质,全部由短周期元素组成,能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。试写出符合条件的两种不同种类的物质(写化学式)_________________、________________。
(2)中学常见的某反应的化学方程式为A+B→C+D+H2O(未配平,反应条件略去)。若C、D均为气体,且都能使澄清石灰水变浑浊。
某探究性学习小组利用下图中所列装置实验,

证明上述反应中有C、D生成。则b瓶溶液的作用是_____________,装置d中所盛溶液是______。
(3)在一定条件下,RO3nˉ 和Iˉ 发生反应,离子方程式为: RO3nˉ+6Iˉ+6H+==Rˉ+3I2+3H2O , RO3n-中R元素的化合价为 ,R元素的原子最外层电子有 个。
(4)已知M2On2ˉ可与R2ˉ作用,R2ˉ被氧化为R的单质,M2On2ˉ的还原产物中,M为+3价,又知c(M2On2ˉ)=0.3mol/L的溶液100mL可与c(R2ˉ)=0.6mol/L的溶液150mL恰好完全反应,则n值为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是 ( )
A. 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B. 在强碱性溶液中:Na+、K+、Al(OH)4-、CO32-
C. 在碱性溶液中:NH4+、Al3+、SO42-、NO3-
D. 常温下在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于2L恒容密闭容器中,发生如下反应:3A(g) + B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol.L-l。下列判断正确的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol.L-l。下列判断正确的是( )
A. A的转化率为40%
B. 2 min内B的反应速率为0.2 mol.L-l.min-1
C. x=2
D. 若混合气体的密度不变,则表明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧的烟气中含有SO2和NO,直接排放会形成酸雨、污染大气,因此对烟气进行脱硫、脱硝具有重要意义。
(1)选择性催化还原技术是目前成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NO反应生成N2和H2O。
①已知:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
N2(g) + O2(g) ![]() 2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol
则该方法中主要反应的热化学方程式是(请补充完整):
4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g) + 6H2O(g) ΔH =_________
4N2(g) + 6H2O(g) ΔH =_________
②该方法控制反应温度在315~400℃之间,反应不宜过低也不能过高的原因是_________。
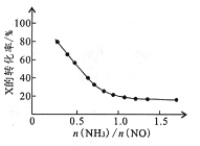
③氨氮比[n(NH3)/n(NO)]的大小会影响该方法的脱硝率。350℃时,只改变NH3的投放量,反应物X的转化率与氨氮比的关系如右图,则X是_____(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____________方向移动。当氨氮比大于1.0时,烟气中NO浓度反而增大,主要原因是___________。
(2)将烟气中的SO2、NO经O3处理后,再用CaSO3悬浊液吸收,可脱硫、脱硝。
已知:O3氧化烟气中SO2、NO的主要反应为:
NO + O3![]() NO2 + O2; 2NO + O2
NO2 + O2; 2NO + O2![]() 2NO2; SO2+ O3
2NO2; SO2+ O3![]() SO3 + O2
SO3 + O2
用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,离子方程式为
_____________。
② 在CaSO3悬浊液中加入Na2SO4溶液可提高NO2的吸收速率,请结合化学原理进行解释___________________________。
③烟气经处理后最终得到含Na+、NO2-、SO42-的吸收液。t℃时,向吸收液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)=_______mol/L。[t℃时,AgNO2(亚硝酸银)的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5。]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com