
【题目】煤燃烧的烟气中含有SO2和NO,直接排放会形成酸雨、污染大气,因此对烟气进行脱硫、脱硝具有重要意义。
(1)选择性催化还原技术是目前成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NO反应生成N2和H2O。
①已知:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
N2(g) + O2(g) ![]() 2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol
则该方法中主要反应的热化学方程式是(请补充完整):
4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g) + 6H2O(g) ΔH =_________
4N2(g) + 6H2O(g) ΔH =_________
②该方法控制反应温度在315~400℃之间,反应不宜过低也不能过高的原因是_________。
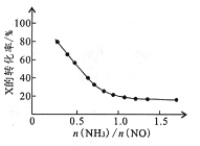
③氨氮比[n(NH3)/n(NO)]的大小会影响该方法的脱硝率。350℃时,只改变NH3的投放量,反应物X的转化率与氨氮比的关系如右图,则X是_____(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____________方向移动。当氨氮比大于1.0时,烟气中NO浓度反而增大,主要原因是___________。
(2)将烟气中的SO2、NO经O3处理后,再用CaSO3悬浊液吸收,可脱硫、脱硝。
已知:O3氧化烟气中SO2、NO的主要反应为:
NO + O3![]() NO2 + O2; 2NO + O2
NO2 + O2; 2NO + O2![]() 2NO2; SO2+ O3
2NO2; SO2+ O3![]() SO3 + O2
SO3 + O2
用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,离子方程式为
_____________。
② 在CaSO3悬浊液中加入Na2SO4溶液可提高NO2的吸收速率,请结合化学原理进行解释___________________________。
③烟气经处理后最终得到含Na+、NO2-、SO42-的吸收液。t℃时,向吸收液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)=_______mol/L。[t℃时,AgNO2(亚硝酸银)的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5。]
【答案】 -1625.5kJ/mol 温度过低,反应速率小(或温度过低,催化剂活性降低);温度过高,使脱硝主要反应的平衡向逆反应方向移动,脱硝率降低。 NH3 正反应 过量氨气与氧气反应生成NO CaSO3+2NO2+2OH-![]() CaSO4+2NO2-+H2O CaSO3(s)+ SO42-(aq)
CaSO4+2NO2-+H2O CaSO3(s)+ SO42-(aq)![]() CaSO4(s) + SO32-(aq),CaSO3转化为CaSO4,使溶液中SO32-浓度增大,加快SO32-与NO2的反应速率。 4.5×10-4
CaSO4(s) + SO32-(aq),CaSO3转化为CaSO4,使溶液中SO32-浓度增大,加快SO32-与NO2的反应速率。 4.5×10-4
【解析】试题分析:(1)①根据盖斯定律计算4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g) + 6H2O(g)的ΔH;②根据平衡移动、反应速率选择反应条件;③增加一种反应物,平衡正向移动;增大氨气的浓度平衡将向正方向移动;当氨氮比大于1.0时,氨气过量,过量氨气与氧气发生4NH3(g) + 5O2(g)
4N2(g) + 6H2O(g)的ΔH;②根据平衡移动、反应速率选择反应条件;③增加一种反应物,平衡正向移动;增大氨气的浓度平衡将向正方向移动;当氨氮比大于1.0时,氨气过量,过量氨气与氧气发生4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)反应;(2)
4NO(g) + 6H2O(g)反应;(2)
用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,N元素化合价降低被还原,CaSO3被氧化为CaSO4;
② 在CaSO3悬浊液中加入Na2SO4溶液,CaSO3转化为CaSO4,使溶液中SO32-浓度增大。
③t℃时,根据Ag2SO4的Ksp=4.0×10-5可计算SO42-恰好完全沉淀时银离子浓度,再根据AgNO2的 Ksp计算c(NO2-);
解析:(1)①根据盖斯定律
① 4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
② N2(g) + O2(g) ![]() 2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol
①-②×4得4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g) + 6H2O(g)的ΔH=-1625.5kJ/mol;②温度过低,反应速率小(或温度过低,催化剂活性降低);温度过高,使脱硝主要反应的平衡向逆反应方向移动,脱硝率降低,所以反应温度在315~400℃之间;③氨气转化率减小,所以应该增大氨气的投放;增大反应物的浓度平衡将向正方向移动;当氨氮比大于1.0时,氨气过量,过量氨气与氧气发生4NH3(g) + 5O2(g)
4N2(g) + 6H2O(g)的ΔH=-1625.5kJ/mol;②温度过低,反应速率小(或温度过低,催化剂活性降低);温度过高,使脱硝主要反应的平衡向逆反应方向移动,脱硝率降低,所以反应温度在315~400℃之间;③氨气转化率减小,所以应该增大氨气的投放;增大反应物的浓度平衡将向正方向移动;当氨氮比大于1.0时,氨气过量,过量氨气与氧气发生4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)反应,所以NO浓度增加;
4NO(g) + 6H2O(g)反应,所以NO浓度增加;
(2)用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,N元素化合价降低被还原,CaSO3被氧化为CaSO4,离子方程式为CaSO3+2NO2+2OH-![]() CaSO4+2NO2-+H2O ;
CaSO4+2NO2-+H2O ;
② 在CaSO3悬浊液中加入Na2SO4溶液,CaSO3(s)+ SO42-(aq)![]() CaSO4(s) + SO32-(aq),CaSO3转化为CaSO4,使溶液中SO32-浓度增大,加快SO32-与NO2的反应速率CaSO3转化为CaSO4,使溶液中SO32-浓度增大。
CaSO4(s) + SO32-(aq),CaSO3转化为CaSO4,使溶液中SO32-浓度增大,加快SO32-与NO2的反应速率CaSO3转化为CaSO4,使溶液中SO32-浓度增大。
③t℃时,根据Ag2SO4的K/span>sp=4.0×10-5可计算SO42-恰好完全沉淀时银离子浓度![]() ,根据AgNO2的 Ksp,c(NO2-)=
,根据AgNO2的 Ksp,c(NO2-)= ![]() 4.5×10-4 。
4.5×10-4 。


科目:高中化学 来源: 题型:
【题目】下列5种烃:①2-甲基丁烷、②2,2-二甲基丙烷、③丙烷、④戊烷、⑤2-甲基丙烷,其沸点按由高到低的顺序排列正确的是( )
A. ①②③④⑤B. ②③④⑤①
C. ⑤②①③④D. ④①②⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )

A.1 个 Ca2+周围距离最近且等距离的 C22-数目为 6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是( )

A. 图I:反应H2+I2![]() 2HI 达平衡后,升高温度时反应速率随时间的变化
2HI 达平衡后,升高温度时反应速率随时间的变化
B. 图Ⅱ:反应2SO2+O2![]() 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化
2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化
C. 图III:反应N2+3H 2![]() 2NH3 在恒温情况下,反应速率与压强的关系
2NH3 在恒温情况下,反应速率与压强的关系
D. 图IV:反应CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化
CO(g)+H2O(g)ΔH>0,水蒸气含量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④2丁醇、⑤酸性KMnO4溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
A. 只有②④⑤B. 只有①③④C. ①②③④⑤D. 只有①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )

A. A是C3H8;B是C6H6 B. A是C4H10;B是C6H6
C. A是C3H6;B是C3H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 具有相同通式的有机物不一定互为同系物
B. 分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
C. 分子式为C3H8与C6H14的两种有机物一定互为同系物
D. 两个相邻同系物的相对分子质量数值相差14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果汁中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有
A.氧化性 B.还原性 C.碱性 D.酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com