
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )

A.1 个 Ca2+周围距离最近且等距离的 C22-数目为 6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金),为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误:
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于2L恒容密闭容器中,发生如下反应:3A(g) + B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol.L-l。下列判断正确的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol.L-l。下列判断正确的是( )
A. A的转化率为40%
B. 2 min内B的反应速率为0.2 mol.L-l.min-1
C. x=2
D. 若混合气体的密度不变,则表明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是 ( )

A. 图1中,Zn—MnO2干电池放电时,MnO2被氧化
B. 图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C. 图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-=4Al2Cl7-
D. 图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽很少,却是维持正常生命活动不可缺少的。下列实例 可证实该理论的是( )
A. 缺Mg 叶片变黄
B. 油菜缺B时只开花不结果
C. 动物血液中钙盐的含量太低会抽搐
D. 缺P会影响ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种简单可行的测定阿伏伽德罗常数的方法,具体步骤为:①将固体NaCl细粒干燥后,准确称取m克NaCl固体并转移到定容仪器A中;②用滴定管向仪器A中滴加苯,不断振荡,继续加苯至A仪器的刻度处计算出NaCl固体的体积为Vml,请回答下列问题:
(1)步骤①中A仪器最好用______________
A、量筒 B、烧杯 C、容量瓶 D、试管
(2)步骤②中用酸式滴定管还是碱式滴定管______________理由是___________________
(3)能否用水代替苯?_______,理由是_______________________。
(4)已知NaCl晶体中,靠的最近的钠离子与氯离子间的平均距离为acm,用上述方法测得的阿伏伽德罗常数的表达式为:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧的烟气中含有SO2和NO,直接排放会形成酸雨、污染大气,因此对烟气进行脱硫、脱硝具有重要意义。
(1)选择性催化还原技术是目前成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NO反应生成N2和H2O。
①已知:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
N2(g) + O2(g) ![]() 2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol
则该方法中主要反应的热化学方程式是(请补充完整):
4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g) + 6H2O(g) ΔH =_________
4N2(g) + 6H2O(g) ΔH =_________
②该方法控制反应温度在315~400℃之间,反应不宜过低也不能过高的原因是_________。
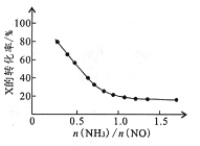
③氨氮比[n(NH3)/n(NO)]的大小会影响该方法的脱硝率。350℃时,只改变NH3的投放量,反应物X的转化率与氨氮比的关系如右图,则X是_____(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____________方向移动。当氨氮比大于1.0时,烟气中NO浓度反而增大,主要原因是___________。
(2)将烟气中的SO2、NO经O3处理后,再用CaSO3悬浊液吸收,可脱硫、脱硝。
已知:O3氧化烟气中SO2、NO的主要反应为:
NO + O3![]() NO2 + O2; 2NO + O2
NO2 + O2; 2NO + O2![]() 2NO2; SO2+ O3
2NO2; SO2+ O3![]() SO3 + O2
SO3 + O2
用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,离子方程式为
_____________。
② 在CaSO3悬浊液中加入Na2SO4溶液可提高NO2的吸收速率,请结合化学原理进行解释___________________________。
③烟气经处理后最终得到含Na+、NO2-、SO42-的吸收液。t℃时,向吸收液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)=_______mol/L。[t℃时,AgNO2(亚硝酸银)的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相应有机物的描述不正确的是( )
A. 甲烷:天然气的主要成分,能发生取代反应
B. 乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
C. 苯:平面结构,每个分子中含有3个碳碳双键
D. 淀粉:属于糖类物质,遇碘单质变蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com