
【题目】同温同压下,等体积的CO2与CO两种气体相等的是( )
A.分子数B.原子数C.质量D.密度
科目:高中化学 来源: 题型:
【题目】已知某无色溶液中含有H+、Mg2+、Al3+几种阳离子,逐滴加入氢氧化钠溶液,消耗氢氧化钠溶液的体积(x轴)和生成沉淀量(y轴)之间的函数关系,正确的是( )
A.
B.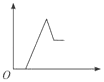
C.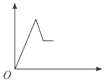
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁卡因毒性较小,是临床常用的局部麻药之一。某兴趣小组以苯和乙烯为主要原料,采用以下路线合成:
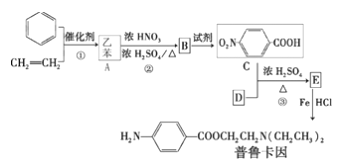
请回答下列问题:
(1)写出下列反应类型,反应①属于_____反应,反应②属于_____反应。写出化合物 B 的结构简式_____。
(2)已知: ![]() 试写出 E 中所含的你学习过的 1 个官能团的名称是:_____ 并写出 C+D→E 反应的化学方程式:_____
试写出 E 中所含的你学习过的 1 个官能团的名称是:_____ 并写出 C+D→E 反应的化学方程式:_____
(3)已知 ![]() 与化合物 B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的 B 的其它 3 个同分异 构体的结构简式_____。
与化合物 B 是同分异构体,且同时符合下列条件①②。写出同时符合下列条件的 B 的其它 3 个同分异 构体的结构简式_____。
①分子中含有羧基 ②H—NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子
(4)α-甲基苯乙烯(AMS)![]() 与乙苯都属于烃类中的同一类别,该类别的名称是_____。 设计一条由 AMS 合成
与乙苯都属于烃类中的同一类别,该类别的名称是_____。 设计一条由 AMS 合成![]() 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池. 
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=﹣1275.6kJmol﹣1②2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJmol﹣1
③H2O(g)=H2O(l)△H3=﹣44.0kJmol﹣1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)CO(g)+3H2(g) ①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则,P1P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为 . (填“<”、“>”“=”)
②100℃时,将1mol CH4和2mol H2O通入容积为1L 的反应室,反应达平衡的标志是: .
A.容器内气体密度恒定
B.单位时间内消耗0.1mol CH4同时生成0.3mol H2
C.容器的压强恒定
D.3v正(CH4)=v逆(H2)
③如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K=
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为 . 用该原电池做电源,常温下,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH= (不考虑溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
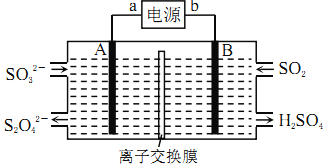
A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1) 表中化学性质最不活泼的元素,其原子结构示意图为________________。
(2) 表中能形成两性氢氧化物的元素是________(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离方程式____________________________________。
(3) ①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为_____________________________________________(用化学式表示)。
(4) ③元素与⑩元素两者核电荷数之差是_____________________________。
(5) 请写出②的氢化物发生催化氧化的化学方程式_______________________________。
(6) 请写出⑤元素的最高价氧化物与⑥元素的最高价氧化物的水化物反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为__________。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:
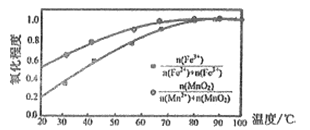
实验过程中应将温度控制在_________。
Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_______。
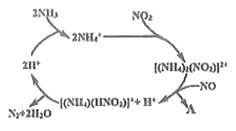
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和__________。
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
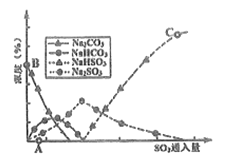
①吸收初期(图中A点以前)反应的化学方程式为__________。
②C点高于B点的原因是__________。
Ⅱ、研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)=2NO(g) ΔH=+1805kJ/mol①
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol②
2C(s)+O2(g)=2CO(g) ΔH-221.0kJ/mol③
(4)某反应的平衡常数表达式![]() ,请写出此反应的热化学方程式:__________。
,请写出此反应的热化学方程式:__________。
(5)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该分应平衡常数保持不变
e.NO和CO的体积比保持不变
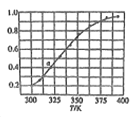
(6)2SO(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp=____(用平衡分压代昝平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,可判断出下列离子方程式中错误的是( ) 
A.2Ag+(aq)+Cd(s)═2Ag(s)+Cd2+(aq)
B.Co2+(aq)+Cd(s)═Co(s)+Cd2+(aq)
C.2Ag(s)+Cd2+(aq)═2Ag+(aq)+Cd(s)
D.2Ag+(aq)+Co(s)═2Ag(s)+Co2+(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com