
����Ŀ��PCl3�ж����ڳ�ʪ�Ŀ����пɷ���ˮ�ⷴӦ���������İ���������ʵ���Һ�ҵ�϶�����Ҫ��Ӧ�á���ʵ��������ȡPCl3����D�з����������ף���Cl2Ѹ�ٶ��Ҳ���ϵ�ͨ��D�У���������ᷢ����Ӧ���������档

���Ȼ������Ȼ��������������£�
�۵� | �е� | |
���Ȼ��� | -112�� | 76�� |
���Ȼ��� | 146�� | 200��ֽ� |
ע�����������Ȼ��ײ��������Ȼ���
��1��д��A�з�����Ӧ�Ļ�ѧ����ʽ��____________________________��
��2����Ӧ��ʼǰ��Ҫ���װ�������ԣ���鷽��Ϊ____________________________��
��3�������Ͱ���Ӧ�ų��������ȣ�Ϊʹ����D������ֲ����ȶ�ը�ѣ�ʵ�鿪ʼǰӦ��D�ĵײ�������____________________________��
��4�����ձ�E�м������ˮ����������____________________________��
��5��������������Ӧ�����п��ܺ���һ������PCl5�����з�������Ȼ��ķ�����______________������һ��ʱ�䷴Ӧ����B����ֱ����Һ���Ͽ������ܵ�ԭ����____________________________��
��6��װ��F��������____________________________��
���𰸡� 2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O �ر�������������B�г����ܼ�ˮ�������Լ�ƿҺ�棬��һ��ʱ�䣬������Һ�治�½������������û��߹رջ�������ƿ���۲�B�е���Һ���Ƿ����� ��ɳ ʹ���Ȼ�������������� ���� ������PCl5�ڵ�������ȴ�ɹ��壬�������� ��ֹ������ˮ�����Ľ��룻���չ���������
����������1��A���Ʊ�������������Ӧ�Ļ�ѧ����ʽΪ2KMnO4+16HCl(Ũ)��2KCl+2MnCl2+5Cl2��+8H2O����2������װ�õĹ����ص��֪�����װ�������Եķ���Ϊ�ر�������������B�г����ܼ�ˮ�������Լ�ƿҺ�棬��һ��ʱ�䣬������Һ�治�½������������û��߹رջ�������ƿ���۲�B�е���Һ���Ƿ���������3�������Ͱ���Ӧ�ų��������ȣ�Ϊʹ����D������ֲ����ȶ�ը�ѣ�ʵ�鿪ʼǰӦ��D�ĵײ���������ɳ����4�����ݱ������ݿ�֪���Ȼ����۷е�ϵͣ��������ձ�E�м������ˮ��������ʹ���Ȼ������������������5�����ڳ��������Ȼ��ײ��������Ȼ��ף��ҳ��������Ȼ����ǹ��壬���Դ��з�������Ȼ��ķ����ǹ��ˡ�����һ��ʱ�䷴Ӧ����B����ֱ����Һ���Ͽ���˵��ѹǿ������˿��ܵ�ԭ���Dz�����PCl5�ڵ�������ȴ�ɹ��壬�������ܡ���6�������������ж���PCl3�ڳ�ʪ�Ŀ����пɷ���ˮ�ⷴӦ���������İ���������װ��F�������Ƿ�ֹ������ˮ�����Ľ��룬ͬʱ���չ�����������


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�е������仯���ɻ�ѧ��Ӧ�оɻ�ѧ������ʱ���յ������뻯ѧ���γ�ʱ�ų���������ͬ����ġ���ͼΪN2(g)��O2(g)��Ӧ����NO(g)�����е������仯������˵������ȷ����
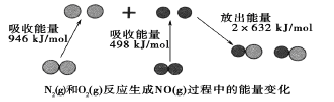
A. 1molN2(g)��1molO2(g)��Ӧ�ų�������Ϊ180kJ
B. 1molN2(g)��1molO2(g)�����������2molNO(g)���������
C. ��1L�������з�����Ӧ��10min��N2������1mol�����10min�ڵ�ƽ����Ӧ����Ϊv(NO)=0��1mol/(L��min)
D. NO��һ���������������NaOH��Һ��Ӧ�����κ�ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʵ�Ľ�����ȷ����
ѡ�� | �������ʵ | ���� |
A | ����NaAlO2��Һ���Ի�ù���NaAlO2 | NaAlO2��ˮ�в���ˮ�� |
B | ʩ��ʱ����ľ��(��Ч�ɷ�ΪK2CO3)������NH4Cl���ʹ�� | K2CO3��NH4Cl��Ӧ���ɰ����ή�ͷ�Ч |
C | Ư���ڿ����о��ñ��� | Ư���е�ClO-����ˮ���HClO |
D | FeCl3��Һ������ˮ���� | FeCl3��Fe3+���������Կ�ɱ������ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L1molL��1NaOH��Һ����0.6molCO2 �� ������Һ��Na2CO3��NaHCO3�����ʵ���֮��ԼΪ�� ��
A.2��3
B.1��2
C.2��1
D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֲ��Ҷ����ȡ�ľ��ͳɷִ�������ת����ϵ��
![]()
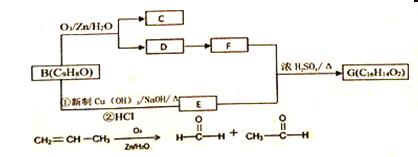
��1��������Dת��ΪFʱ�ķ�Ӧ������__________��A�к��еĹ���������______��
��2�����ڼ�˵����ȷ����________
A.��������Ʒ�Ӧ�ų����� B.1mol���������1molH2�����ӳɷ�Ӧ
C.����һ�����������γɸ߷��ӻ�����
��3��B�����������______��̼ԭ�ӹ���
��4��д��Bת��ΪE�Ļ�ѧ��Ӧ����ʽ��_________________________����____________________________________��
��5��д��E+F��G�Ļ�ѧ��Ӧ����ʽ_________________________��
��6��д����������Ҫ���E��ͬ���칹��Ľṹ��ʽ_____________��
��������ֻ������ȡ���� ����ʹ���CCl4��Һ��ɫ�����������������ܷ���ˮ��
�ۺ˴Ź���������ʾ���շ����֮��1:1:2:2:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��ͨ�����з�Ӧԭ���Ʊ�SO2����������̽������Ӧԭ��Ϊ��Na2SO3(��)+H2SO4(Ũ)�� Na2SO4 + SO2��+ H2O

��1����������ԭ���Ʊ����ռ�����SO2��ʵ��װ������˳��Ϊ________________��(���ͷ���)
��2��D��ʢװ���Լ�Ϊ_________________��
��3����ͬѧ��ע������ȡ������SO2�����װ��G����SO2������ʵ�飬��X��Na2S��Һ����Ŀ���Ǽ���SO2��_____________���ɹ۲쵽������_________ ��
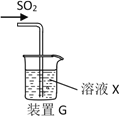
��4��ʵ��1����ͬѧ����ҺX��ΪŨ�Ⱦ�Ϊ0.1mol/L Fe(NO3)3��BaCl2�Ļ����Һ���Ѿ���ȥ�ܽ�������ͨ������SO2��۲쵽�ձ�������ɫ��������ͬѧ��Ϊ��ɫ����ΪBaSO4��Ϊ̽����ɫ�����ij�����������������ʵ����֤������֪��0.1mol/L Fe(NO3) 3��pH=2��
ʵ�� | ���� | ���� | ���ۺͽ��� |
2 | ��SO2ͨ��0.1mol/L ____��BaCl2���Һ | ������ɫ���� | Fe3+������H2SO3 |
3 | ��SO2ͨ��_______ �� BaCl2���Һ | ������ɫ���� | ��������NO3-�ܽ�H2SO3����ΪSO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ɫ��Ӧ��˵��������ǣ� ��
A.�۲�K2SO4����ɫӦ����ɫ���ܲ���
B.Na��NaCl������ʱ������ɫ��ͬ
C.��������ɫ��Ӧ������NaCl��KCl
D.��ɫ��Ӧһ��������ѧ�仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
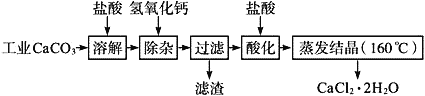
����Ŀ��ҽ���Ȼ��ƿ������������ơ������������ȣ��Թ�ҵ̼��ƣ�������Na+��Al3+��Fe3+������)����ҽҩ����ˮ���Ȼ���(CaCl2��2H2O����������Ϊ97.0%��103.0%)����Ҫ�������£�
��֪��
�������� | Fe��OH��3 | Al��OH��3 | Al��OH��3 | |
��ʼ����ʱ��pH | 2.3 | 4.0 | ��ʼ�ܽ�ʱ��pH | 7.8 |
��ȫ����ʱ��pH | 3.7 | 5.2 | ��ȫ�ܽ�ʱ��pH | 10.8 |
��1��CaCO3�����ᷴӦ�����ӷ���ʽ___________��
��2�������ӡ������Ǽ����������ƣ�������Һ��pH��ΧΪ________��Ŀ���dz�ȥ��Һ�е�����Al3+��Fe2+��
��3������ʱ���õıȲ�������__________��
��4�����ữ�������Ǽ������ᣬ������Һ��pHԼΪ4.0����Ŀ���У�����ֹ�����������տ����еĶ�����̼������ֹCa2+������ʱˮ�⣻��_______��
��5�������ᾧҪ������160����ԭ����__________��
��6���ⶨ��Ʒ��Cl-�����ķ����ǣ���ȡ0.750 0 gCaCl2��2H2O��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ���ȡ25.00 mL������Һ����ƿ�У���0.050 00 mol/L AgNO3��Һ�ζ����յ㣨��K2Cr2O2��������AgNO3��Һ�����ƽ��ֵΪ20.39 mL��
�������ⶨ������������Һ��ϴ��������________��
������������Ʒ��CaCl2��2H2O����������Ϊ_______����������λ��Ч���֣�
���������������ⶨ����Ʒ��CaCl2��2H2O����������ƫ��(�ⶨ�����в��������ɺ���)�������ԭ����________��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������ܹ��Ի�ѧ��Ӧ�ٶ���������õ��ǣ� ��
A. �¶� B. Ũ�� C. ���� D. ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com