
【题目】从樟科植物叶中提取的精油成分存在如下转化关系:
![]()
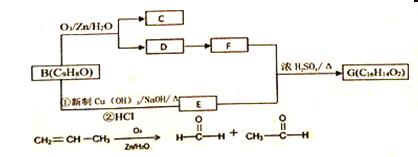
(1)物质由D转化为F时的反应类型是__________;A中含有的官能团名称______。
(2)关于甲的说法正确的是________
A.能与金属钠反应放出氢气 B.1mol甲最多能与1molH2发生加成反应
C.甲在一定条件下能形成高分子化合物
(3)B分子中最多有______个碳原子共面
(4)写出B转化为E的化学反应方程式①_________________________;②____________________________________。
(5)写出E+F→G的化学反应方程式_________________________。
(6)写出符合下列要求的E得同分异构体的结构简式_____________。
①苯环上只有两个取代基 ②能使溴的CCl4溶液褪色,且在酸性条件下能发生水解
③核磁共振氢谱显示吸收峰面积之比1:1:2:2:2
【答案】 还原(加成) 氯原子、醛基 AC 9 ![]()
![]()
![]()
![]()
【解析】根据已知信息可知A、B的结构简式分别为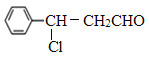 、
、![]() ,根据B转化为E的反应条件可知E的结构简式为
,根据B转化为E的反应条件可知E的结构简式为![]() ,E与F发生酯化反应生成G,则根据G的分子式可知F的结构简式为
,E与F发生酯化反应生成G,则根据G的分子式可知F的结构简式为![]() ,则根据已知信息可知D的结构简式为
,则根据已知信息可知D的结构简式为![]() ,C的结构简式为OHC-CHO。
,C的结构简式为OHC-CHO。
(1)根据以上分析可知物质由D转化为F时醛基与氢气发生加成反应;A中含有的官能团名称为氯原子、醛基。(2)A.甲分子中含有羟基,能与金属钠反应放出氢气,A正确;B.苯环和碳碳双键均与氢气发生加成反应,1mol甲最多能与4molH2发生加成反应,B错误;C.分子中含有碳碳双键,甲在一定条件下能形成高分子化合物,C正确;答案选AC;(3)苯环、碳碳双键和醛基均是平面形结构,则B分子中最多有9个碳原子共面;(4)B转化为E的化学反应方程式依次为![]() 、
、![]() 。(5)E+F→G的化学反应方程式为
。(5)E+F→G的化学反应方程式为![]() 。(6)①苯环上只有两个取代基;②能使溴的CCl4溶液褪色,含有碳碳双键,且在酸性条件下能发生水解,含有酯基;③核磁共振氢谱显示吸收峰面积之比1:1:2:2:2,因此符合条件的有机物结构简式为
。(6)①苯环上只有两个取代基;②能使溴的CCl4溶液褪色,含有碳碳双键,且在酸性条件下能发生水解,含有酯基;③核磁共振氢谱显示吸收峰面积之比1:1:2:2:2,因此符合条件的有机物结构简式为![]() 。
。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】某小组用图1图2所示装置进行溴乙烷性质的探究。在图1试管中加入5mL溴乙烷和10mL 6mol/L NaOH水溶液,振荡,水浴加热。将溴乙烷与NaOH乙醇溶液反应产生的气体通入图2装置。下列说法正确的是

A. 图1图2装置中分别发生的是消去反应和取代反应
B. 图1试管中物质充分反应后,可观察到液体出现分层
C. 图2中试管A的作用是除去气体中混有的溴乙烷
D. 图2若无试管A,可将B中试剂改为溴的四氯化碳溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素原子的L电子层上有6个电子,则该元素在周期表中位于( )
A. 第3周期IVA族 B. 第2周期VIA族
C. 第2周期IVA族 D. 第3周期VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图②是电解法除去工业废水中的Cr2O72-.下列说法正确的是
A. 图②中Cr2O72-离子向铁电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图②中阳极上的电极反应式为:Fe-3e-═Fe3+
C. 图①中发生的氧化反应是:ClO-+H2O+2e-═Cl-+2(OH)-
D. 若图①中7.2g镁溶解产生的电量用以图②废水处理,理论可除去Cr2O72-的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y
的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. 氢化物的稳定性:X >W
B. 离子半径:X >Y
C. 氧化物水化物的酸性W > Z
D. Z与X属于同一主族,与Y属于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中制取PCl3,在D中放入足量白磷,将Cl2迅速而且不间断地通入D中,氯气与白磷会发生反应,产生火焰。

三氯化磷和五氯化磷的物理常数如下:
熔点 | 沸点 | |
三氯化磷 | -112℃ | 76℃ |
五氯化磷 | 146℃ | 200℃分解 |
注:常温下五氯化磷不溶于三氯化磷
(1)写出A中发生反应的化学方程式:____________________________。
(2)反应开始前需要检查装置气密性,检查方法为____________________________。
(3)氯气和白磷反应放出大量的热,为使仪器D不致因局部过热而炸裂,实验开始前应在D的底部放少量____________________________。
(4)在烧杯E中加入冰盐水,其作用是____________________________。
(5)白磷与氯气反应产物中可能含有一定量的PCl5,从中分离出三氯化磷的方法是______________。经过一段时间反应发现B中竖直导管液面上开,可能的原因是____________________________。
(6)装置F的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________ mol·L1(计算结果保留 2位有效数字)。
(2)某同学取 100mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中 c(Na+)=_______ mol·L1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制 480mL含NaClO质量分数为25%的消毒液。下列说法正确的是______(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B. 将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶并加水至刻度线
C. 定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO固体的质量为 143.0g

(4)该同学对容量瓶及其使用方法的认识中正确的是________
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后, 需要烘干后再使用
C.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
D.使用前要检查容量瓶是否漏水
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm3)的浓硫酸配制 2L 2.3mol·L1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为_______ mol·L1。
②需用浓硫酸的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
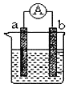
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,SO42向_____极(填a或b)移动,正极的电极反应式为_______________________________。
(2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,该原电池工作时,电子从_____极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上消耗Al的质量是________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com