
【题目】为了验证ⅦA族部分元素非金属性递变规律,设计如图进行实验,
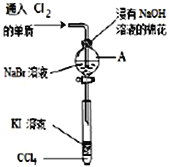
(1)仪器A的名称是______________,A中发生反应的离子方程式是______________________;
(2)为了验证溴和碘的非金属性强弱,通入C12单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象的___________________________;
(3)ⅦA族元素,非金属性随着原子序数的增加而逐渐减弱的原因:同主族元素从上到下,________________________,得电能力减弱。
(4)阅读上述实验操作步骤,为确保实验结论可靠,你认为做好本实验最关键的因素是_____________。
【答案】 分液漏斗 2Br-+Cl2=Br2+2Cl- 分层上层几乎无色下层呈紫红色 核电荷数增加,原子半径增大 通入氯气少量
【解析】考查实验方案设计与评价,(1)根据仪器的特点,仪器A为分液漏斗;因为氯气的氧化性强于Br2,因此发生的离子方程式为Cl2+2Br-=2Cl-+Br2;(2)Br2和I2易溶于有机溶剂,四氯化碳不溶于水,出现分层,因为四氯化碳的密度小于水,因此下层为四氯化碳,上层为水溶液,Br2在四氯化碳中颜色是橙红色,即如果下层为橙红色,说明Br的非金属性弱于I,I2在四氯化碳中的颜色是紫红色,即如果下层为紫红色,说明Br的非金属性强于I;(3)同主族随着核电荷数的增加,原子半径增大,对最外层电子的吸引能力减弱,得电子能力减弱;(4)防止氯气过量,氯气把I-氧化,因此最关键的因素是通入氯气的量少。


科目:高中化学 来源: 题型:
【题目】下列能正确表示热化学方程式中△H的含义的是( )
A.H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H(中和热)
B.![]() H2SO4(浓)+NaOH(aq)═
H2SO4(浓)+NaOH(aq)═ ![]() Na2SO4(aq)+H2O(l)△H(中和热)
Na2SO4(aq)+H2O(l)△H(中和热)
C.2H2(g)+O2(g)═2H2O(l)△H (燃烧热)
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H(燃烧热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行Fe3+和Cu2+分离实验时,不能让流动相溶剂没及试样斑点的原因是( )
A.Fe3+和Cu2+会溶解在层析液中,使实验结果不明显
B.滤纸上Fe3+和Cu2+会扩散不均匀影响实验效果
C.滤纸上的滤液细线会变粗而使Fe3+和Cu2+太分散
D.滤纸上的Fe3+和Cu2+会混合起来不分散
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na2O2粉末加到滴有紫色石蕊试液的水中,并振荡,观察到的现象( )
A. 溶液仍为紫色B. 溶液最终为蓝色
C. 最终溶液褪色,而无其它现象D. 溶液中有气泡产生,溶液最终变为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素同周期,且从左到右按原子序数的递增(原子序数为五个连续的自然数)的顺序排列如下:
![]()
下列说法正确的是
A. 若HnCOm为强酸,则D元素肯定是活泼的非金属元素
B. 若A(OH)n为强碱,则B(OH)m也一定为强碱
C. 若C的最高正化合价为+5价,则五种元素均为非金属元素
D. 若D的最低负化合价为-2价,则E的最高正价为+6价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量浓度关系中,正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO ![]() )>c(NH
)>c(NH ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
B.室温下,pH=3的醋酸与pH=11的NaOH溶液等体积混合:c (Na+)>c (CH3COO﹣)>c(OH﹣)>c(H+)
C.浓度均为0.1 mol?L﹣1CH3COONa、NaHCO3、 ![]() ﹣ONa溶液中:若c(OH﹣)分别为c1、c2、c3 , 则c3>c2>c1
﹣ONa溶液中:若c(OH﹣)分别为c1、c2、c3 , 则c3>c2>c1
D.NaHCO3溶液中:c(Na+)=c(H2CO3)+c(HCO ![]() )+2c(CO
)+2c(CO ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。 下列叙述错误的是
A.疫苗因未冷藏储运而失效,与蛋白质变性有关
B.天然气既是高效清洁的化石燃料,又是重要的化工原料
C.“中国天眼”的镜片材料为SiC,属于新型有机非金属材料
D.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com