
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
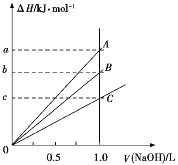
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,合金完全溶解,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述正确的是( )
A.反应中转移电子的总数为0.3mol
B.反应过程中,消耗硝酸的物质的量为0.3mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.开始加入合金的质量可能为3.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,只含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

回答下列问题:
(1)上述反应,其中是氧化还原反应的有___个;写出试剂X的化学式___。
(2)反应②的离子反应方程式______________。
(3)反应①后过滤的沉淀为_____,简述确定此物质中金属元素及其价态的操作过程____。
(4)反应①后过滤时必须用到的玻璃仪器有______________。
(5)请你写出检验试剂X中含有阳离子的实验操作: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质能与H2反应
H2+F2═2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2═2HCl | 光照或点燃发生反应 |
H2+Br2═2HBr | 加热至一定温度才能反应 |
H2+I2═2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的族.
(2)用电子式表示HCl的形成过程 .
(3)依据上表,可以推测出:随着原子序数的递增,(填字母).
a.单质的熔沸点逐渐升高 b.元素的非金属性逐渐减弱
c.卤化氢的还原性依次减弱 d.卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近.写出BrCl和SO2在水溶液中发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( ) 
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C.加适量NH4Cl固体可使溶液由a点变到b点
D.c、d两点代表的溶液中c(H+)与c(OH﹣)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是氧化性酸,其本质是NO3﹣有氧化性,某课外实验小组进行了下列有关NO3﹣氧化性的探究(实验均在通风橱中完成).
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6molL﹣1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
实验Ⅱ | 15molL﹣1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
(1)实验Ⅰ中,铝片作(填“正”或“负”)极.液面上方产生红棕色气体的化学方程式是 .
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是 .
查阅资料:活泼金属与1molL﹣1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3﹣被还原.
(3)用如图装置进行实验Ⅲ:溶液X为1molL﹣1稀硝酸溶液,观察到电流计指针向右偏转.
①反应后的溶液中含NH4+ . 实验室检验NH4+的方法是 .
②生成NH4+的电极反应式是 .
(4)进一步探究碱性条件下NO3﹣的氧化性,进行实验Ⅳ: 
①观察到A中有NH3生成,B中无明显现象.A、B产生不同现象的解释是 .
②A中生成NH3的离子方程式是 .
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离程度为α1 , pH=2的醋酸溶液中水的电离程度为α2 , pH=12的氢氧化钠溶液中水的电离程度为α3 . 若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离程度为α4 . 下列关系式中正确的是( )
A.α2=α3<α4<α1
B.α3=α2<α1<α4
C.α2<α3<α1<α4
D.α1<α2<α3<α4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1= .
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:>>
(3)①如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是(填化学式).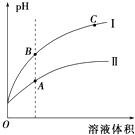
②a、b、c三点中,水的电离程度最大的是(填字母).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com