
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1= .
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:>>
(3)①如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是(填化学式).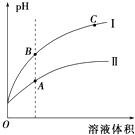
②a、b、c三点中,水的电离程度最大的是(填字母).
【答案】
(1)![]()
(2)H2CO3;HSO3﹣;HCO3﹣
(3)CH3COOH;C
【解析】解:(1)碳酸的第一级电离方程式为H2CO3H++HCO3﹣ , 电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,则K1= ![]() ,碳酸的第二步电离由于第一步电离产生的氢离子对第二步有抑制作用,所以比第一步困难,
,碳酸的第二步电离由于第一步电离产生的氢离子对第二步有抑制作用,所以比第一步困难,
所以答案是: ![]() ;(2)H2CO3、HCO3﹣和HSO3﹣的电离平衡常数分别是:4.30×10﹣7、5.61×10﹣11、1.02×10﹣7 , 所以酸性顺序是:H2CO3>HSO3﹣>HCO3﹣ ,
;(2)H2CO3、HCO3﹣和HSO3﹣的电离平衡常数分别是:4.30×10﹣7、5.61×10﹣11、1.02×10﹣7 , 所以酸性顺序是:H2CO3>HSO3﹣>HCO3﹣ ,
所以答案是:H2CO3;HSO3﹣;HCO3﹣;(3)酸的酸性越强,加水稀释时pH变化越大,醋酸的酸性比碳酸强,所以曲线I表示的酸是CH3COOH;酸溶液中,氢离子浓度越大即pH越大,水的电离程度越小,所以ABC三点水的电离程度最大的是C点,
所以答案是:CH3COOH;C.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
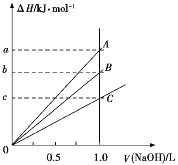
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411 kJ能量: 。
(2)1 mol C2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8 kJ热量: 。
(3)2 mol Al(s)与适量O2(g)发生反应生成Al2O3(s),放出1669.8 kJ热量: 。
(4)在200°C、101 kPa时,1 mol H2与碘蒸气作用生成HI气体,放出14.9 kJ热量: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是( )
A.Na、Mg、Al原子的失电子能力逐渐减弱
B.Si、P、S元素的最高正化合价依次降低
C.C、N、O的原子半径依次减小
D.Cl、Br、I的气态氢化物的稳态性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关石油加工及其产品的说法不正确的是( )
A. 石油的分馏是物理变化
B. 石油裂化的主要目的是提高汽油的产量和质量
C. 石油催化重整的主要目的是得到芳香烃
D. 直馏汽油和裂化汽油均可萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯碱工业与燃料电池联合能够有效降低能源消耗,如图是该工艺的图示(电源及电极未标出),请回答下列问题: 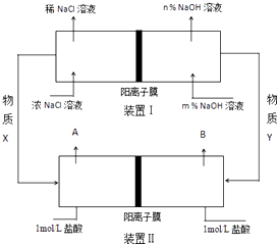
(1)电解饱和食盐水(氯碱工业)的化学方程式为 .
(2)物质X为 , 装置Ⅰ和Ⅱ中属于燃料电池的是 .
(3)装置Ⅰ中,NaOH溶液浓度m%n% (填“>”或“<”).
(4)利用装置Ⅱ可获得10mol/L盐酸,该产品出口为(填“A”或“B”),请说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的浓度的说法正确的是( )
A.将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液
B.500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl﹣)仍然是3mol/L(忽略混合后体积变化)
D.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com