
| A、①和② | B、①和④ |
| C、②和③ | D、②和④ |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:

| A、检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 |
| B、化合物2在一定条件下可发生加聚反应 |
| C、理论上反应1→2中原子利用率100% |
| D、等物质的量的四种物质与足量NaOH溶液反应,消耗NaOH物质的量比为1:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
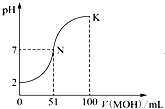 常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧化还原反应中,甲失的电子比乙多 |
| B、将甲和乙用导线相连接,一同放入CuSO4溶液中,乙的表面有红色的铜析出 |
| C、同价态阳离子,甲比乙氧化性强 |
| D、将甲、乙组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )
前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图所示,和l mol该化合物起反应的H2或NaOH的最大值分别是( )| A、5 mol,2 mol |
| B、7 mol,2 mol |
| C、6 mol,1 mol |
| D、7 mol,1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2,H2和NH3的物质的量分数不再改变 |
| B、c(N2):c(H2):c(NH3)=1:3:2 |
| C、N2与H2的物质的量之和是NH3的物质的量2倍 |
| D、单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(SO2)=0.4mol/L |
| B、c(SO2)=c(SO3)=0.15mol/L |
| C、c(SO2)=0.25mol/L |
| D、c(SO3)=0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2=2FeCl3+4FeI3 |
| B、每1 mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e- |
| C、FeCl3溶液能使淀粉-KI试纸变蓝 |
| D、I2具有较强的氧化性,可以将Co2+氧化成Co2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com