
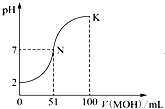
 常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下向100mL 0.01mol?L-1 HA溶液中逐滴加入0.02mol?L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:| 0.002mol |
| 0.2L |
| 1 |
| 2 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
 X+CH2═CH-R
X+CH2═CH-R| Pd |
| 碱 |
 CH═CH-R+HX (X为卤素原子,R为取代基)经由Heck反应合成M(一种防晒剂)的路线如下:
CH═CH-R+HX (X为卤素原子,R为取代基)经由Heck反应合成M(一种防晒剂)的路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷 | B、乙醇 |
| C、橄榄油 | D、苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、具有相似的化学性质 |
| B、具有相同的物理性质 |
| C、是不同的物质 |
| D、分子式相同,但分子内碳原子的连接方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和② | B、①和④ |
| C、②和③ | D、②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A. | B. | C. | D. | |
| Y | Na2CO3 | SiO2 | Fe2O3 | H2O |
| W | NaHCO3 | CO | Al2O3 | NaOH |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com