
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:
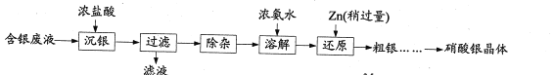
已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
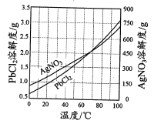
③PbCl2、AgNO3的溶解度曲线如图所示:
(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
【答案】NH4+ 热水溶解,趁热过滤 将Ag2S中S2-氧化 ![]()
![]() 将水洗后所得粗银溶于过量得稀硫酸中 洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应 加热浓缩、冷却结晶
将水洗后所得粗银溶于过量得稀硫酸中 洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应 加热浓缩、冷却结晶
【解析】
由实验流程可知,含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}与浓盐酸反应生成AgCl(含有少量PbCl2、Ag2S)和滤液,然后除去杂质PbCl2、Ag2S,将AgCl溶于浓氨水中,再利用过量的Zn置换Ag,将水洗后所得粗银溶于过量得稀硫酸中,过滤,滤渣加入过量稀硝酸充分反应,将所得AgNO3溶液,加热浓缩、冷却结晶,得到硝酸银晶体,以此分析。
(1)含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}与浓盐酸发生反应:![]() ,
,![]() ,则滤液中主要阳离子为NH4+,
,则滤液中主要阳离子为NH4+,
故答案为:NH4+;
(2)根据溶解度曲线可知PbCl2的溶解度随着温度的升高而增大,则除去PbCl2的操作为热水溶解,趁热过滤,热水洗涤;利用浓硝酸可以氧化S2-使沉淀平衡正移,再加入稀盐酸,生成AgCl沉淀,则除去Ag2S的操作为向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl,
故答案为:热水溶解,趁热过滤;将Ag2S中S2-氧化;
(3)![]() 的平衡常数K,=1.1×107,Ksp(AgCl)= 1.8×10-10,则反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数
的平衡常数K,=1.1×107,Ksp(AgCl)= 1.8×10-10,则反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数 ,
,
故答案为:![]() ;
;
(4)Zn与银氨溶液反应方程式为:![]() ,
,
故答案为:![]() ;
;
(5)粗银中含有少量的Zn,以水洗后粗银为原料,制备硝酸银晶体的实验方案为:将水洗后所得粗银溶于过量得稀硫酸中,过滤,洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液热浓缩、冷却结晶,将所得晶体置于烘箱 (120℃)干燥,密封包装。
故答案为:将水洗后所得粗银溶于过量得稀硫酸中;洗涤至最后一次洗涤液中加入BaCl2溶液无现象,向滤渣中加入过量稀硝酸充分反应;加热浓缩、冷却结晶。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】过氧化钙在工农业生产中有广泛的用途。
Ⅰ.过氧化钙制备方法很多。
(1)制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为______________________________________________________________。
(2)制备方法二:利用反应Ca(s)+O2![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
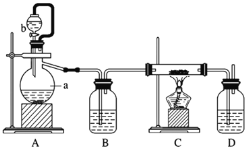
请回答下列问题:
①装置A中反应的化学方程式为________________,仪器a的名称为 ___________。
②装置D中盛有的液体是浓硫酸,其作用一是_________;二是_____________。
Ⅱ.水产运输中常向水中加一定量CaO2·8H2O增加溶氧量(DO),水中溶氧量(DO)是用每升水中溶解氧气的质量来表示,其测定步骤及原理为:
a.固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH=2MnO(OH)2↓;
b.氧化:酸性下,MnO(OH)2将I氧化为I2:MnO(OH)2+2I+4H+=Mn2++I2+3H2O;
c.滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I。
某同学向水中加一定量CaO2·8H2O,取此水样100.00mL,按上述方法测定水中溶氧量(DO),消耗0.0100mol·L1 Na2S2O3标准溶液13.50mL。
(1)滴定过程中使用的指示剂是_______________________________;
(2)该水样中的溶解氧量(DO)为__________________mg·L1。
(3)步骤b中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因________________________(用离子方程式表示,至少写出2个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(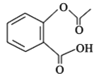 )是一种用途很广的消炎镇痛药物。可以通过以下方法合成:
)是一种用途很广的消炎镇痛药物。可以通过以下方法合成:

已知:
![]() +
+![]()
![]()
![]() +HCl
+HCl
3CH3COOH+PCl3→3CH3COCl+H3PO3
请回答下列问题:
(1)阿司匹林中的含氧官能团有____(写名称),反应①的化学反应类型为____。
(2)通过水杨酸还可制得香料E和高分子化合物G:
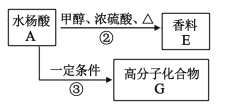
①请写出A→E的化学反应方程式____。
②已知G是一种聚酯,请写出其结构简式____。
(3)写出水杨酸所有属于芳香酯的同分异构体的结构简式____。
(4)结合题中信息,以苯酚、异丁烯为原料(其它无机原料自选)合成聚合物 的流程路线如下:
的流程路线如下:![]()
![]() ……→
……→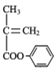 →
→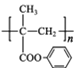 。请完善合成流程省略部分____。
。请完善合成流程省略部分____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4L乙烯中C-H键数为4NA
B.1.5g甲基中电子数为1.0NA
C.标准状况下,22.4L苯中含有的碳原子数为6.0NA
D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。完成下列填空:
(1)由重油制得汽油的方法是___。
(2)乙烯是重要的石油化工产品。与乙烯互为同系物的是___。(选填编号)
A.CH3CH=CH2 B.CH2=CHCH=CH2
C.CH≡CH D.CH3CH3
(3)聚乙烯安全无毒,可用于制食品包装袋。聚乙烯的结构简式为___。
(4)聚氯乙烯用途广泛,其单体的结构简式为___。请写出由乙炔制取聚氯乙烯的化学方程式___。乙炔还可聚合得到另一种高分子化合物——聚乙炔,聚乙炔___导电(选填“能”或“不能”)。
(5)乙炔在不同的催化条件下加氢可得到不同的产物。请写出乙炔的电子式:___。
下列物质与乙炔加氢得到的某种产物互为同系物的是___多(选填编号)。
A.C2H4 B.C3H8 C.![]() D.CH2=CHCH3
D.CH2=CHCH3
(6)乙炔能使溴水褪色、说明乙炔能发生___反应(填反应类型);乙炔能使酸性高锰酸钾溶液褪色,说明乙炔容易被___。
(7)乙炔在一定条件下三聚得到CH2=CH—C≡C—CH=CH2,写出与该三聚物具有相同化学式且不易发生加成反应的物质的结构简式___。该物质的同系物中苯环上一氯代物只有一种的物质的结构简式为___(举一例):。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁在元素周期表中的位置为_____,基态铁原子有个未成对电子_____,三价铁离子的电子排布式为_____。
(2)基态Si原子中,电子占据的最高能层符号_____,该能层具有的原子轨道数为_____;铝元素的原子核外共有_____种不同运动状态的电子、_____种不同能级的电子。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____形象化描述。在基态14C原子中,核外存在_____对自旋相反的电子。
(4)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
(5)有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥CH4,⑦H2,⑧H2O2,⑨HCN(H—C≡N),⑩Ar,既有σ键又有π键的是______;含有由两个原子的s轨道重叠形成的σ键的是______;不存在化学键的是______。
(6)在BF3分子中,F—B—F的键角是______,硼原子的杂化轨道类型为______,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]_______;与硒同周期的p区元素中第一电离能大于硒的元素有_____种;SeO3的空间构型是_______。
(2)根据元素周期律,原子半径Ga ___As,第一电离能Ga _____As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______,硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4 、SiBr4,上述四种物质的沸点由高到低的顺序为__________,丁硅烯(Si4H8)中σ键与π键个数之比为___。
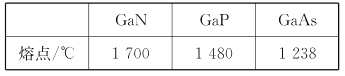
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因___。
(5)GaN晶体结构如图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。
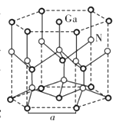
①晶体中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____。
②从GaN晶体中“分割”出的平行六面体如图所示。若该平行六面体的体积为![]() cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
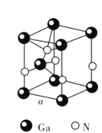
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物是苯环上一个
的有机物是苯环上一个![]() 原子被取代后得到的物质,下列判断错误的是( )
原子被取代后得到的物质,下列判断错误的是( )
A.![]() 属于苯的同系物
属于苯的同系物
B.该有机物的结构有4种
C.该有机物的某种结构的核磁共振氢谱有4组峰
D.该有机物所有结构的一溴代物种类相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com