
| A. | $\frac{71b}{161(b+36a)}$×100% | B. | $\frac{71}{161}$×100% | ||
| C. | $\frac{b}{b+36a}$×100% | D. | $\frac{71b}{161(b+18a)}$×100% |
分析 电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,根据质量分数公式计算即可.
解答 解:电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电生成氢气,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,bg Na2SO4•10H2O硫酸钠的质量为:bg×$\frac{142}{322}$=$\frac{71b}{161}$g;
设电解水的质量为x,
则:2H2O$\frac{\underline{\;通电\;}}{\;}$O2↑+2H2↑,
36g 2mol
x amol
x=18ag,
所以饱和溶液的质量分数为:$\frac{\frac{71b}{161}}{b+18a}$×100%=$\frac{71b}{161(b+18a)}$×100%,
故选D.
点评 本题以电解原理为载体考查了质量分数的计算,题目难度中等,明确电解后析出的硫酸钠晶体和电解的水组成的是饱和溶液是解本题的关键,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | Cu(OH)2+2HCl═CuCl2+2H2O | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
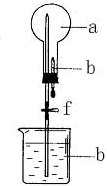 在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )
在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )| a(干燥气体) | b(液体) | |
| A | NH3 | 紫色石蕊水溶液 |
| B | Cl2 | 紫色石蕊水溶液 |
| C | HCl | 酚酞 |
| D | NH3 | 酚酞 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
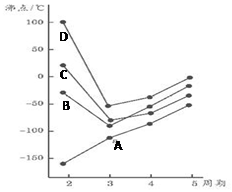 如图为四、五、六、七主族元素简单氢化物沸点随周期变化图象,(A、B、C、D代表氢化物中另外一种元素)分析图象,下列说法正确的是( )
如图为四、五、六、七主族元素简单氢化物沸点随周期变化图象,(A、B、C、D代表氢化物中另外一种元素)分析图象,下列说法正确的是( )| A. | A元素氧化物晶体中存在分子间作用力 | |
| B. | A、B、C、D非金属性由小到大的顺序是:A<B<D<C | |
| C. | D的氢化物固态比液态时密度大 | |
| D. | B元素一种氢化物可做火箭的染料,为CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个阴离子的Na2O2溶于水形成1L溶液,其物质的量浓度为2mol/L | |
| B. | 25g质量分数为68%的H2O2水溶液中含有氧原子数目为NA | |
| C. | 标准状况下,22.4L H2O含有的分子数为NA | |
| D. | 用5mL 3mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com