
【题目】不属于氮肥的是
A. 硫酸铵 B. 尿素 C. 草木灰 D. 硝酸钾
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
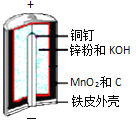
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
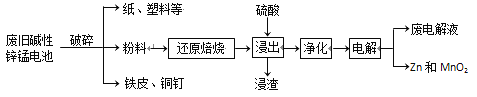
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.写出下列反应的离子方程式:
(1)将鸡蛋壳在醋酸中溶解有气泡产生:_____________________________________________;
(2)CuSO4溶液与Ba(OH)2溶液混合:________________________________________。
Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有![]() 、Na+、
、Na+、![]() 、H+、
、H+、![]() 、
、![]() 、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________,一定不存在的离子是____________。
(2)在上述实验操作中,有错误的步骤是(填代号)______。对该错误改正的方法是(要作较详细的说明)_________________________________________________________。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属厲钨(W)可做灯泡的灯丝,钨合金材料非常坚硬和耐磨、耐热。用黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧可以得到Na2WO4,Na2WO4与热的浓盐酸反应生成H2WO4,H2WO4受热分解生成H2O和WO3。
(1)钨合金材料属于__________。(填选项)
A.单质 B.化合物 C.纯净物 D.混合物
(2)4FeWO4+4Na2CO3+O2![]() 4Na2WO4+2Fe2O3+4______。H2WO4读作_______。H2WO4中钨元素的化合价为_______。
4Na2WO4+2Fe2O3+4______。H2WO4读作_______。H2WO4中钨元素的化合价为_______。
(3)H2与WO3在1000℃条件下发生反应可得到金属W,其反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应类型中可以吸收能量的反应是
①化合反应 ②分解反应 ③置换反应 ④复分解反应 ⑤氧化还原反应
A. ①②③④⑤B. ②④C. ①③④⑤D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是 ( )
A. 1mol NaCl分子中含有1mol Na+和1mol Cl-
B. 离子化合物和共价化合物溶于水都能导电
C. 离子键的形成一定有电子的得失
D. KOH溶于水电离出K+ 和OH- 不是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是

A. 实验I:振荡后静置,上层溶液颜色保持不变
B. 实验II:试管溶液中中出现气泡,溶液先出现浑浊后变澄清
C. 实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验IV:加热至混合液呈红褐色,停止加热,该分散系产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、BaCl2、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数。
①取少量样品于试管中,加水振荡,未见沉淀生成;
②透过蓝色钴玻璃观察,焰色反应无紫色;
③用下图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)

请回答下列问题:
⑴按气流从左到右方向,正确的连接顺序为:A接___,___接____,___接B。
⑵利用所组装置,由分液漏斗向圆底烧瓶中滴加10mL水,将排入量筒中___mL液体。
⑶液体X是____________,其作用是______________________________。
⑷Y的作用是防止产生的气体溶于水,下列所给试剂符合要求的是______。
A.苯 B.四氯化碳 C.酒精 D.汽油
⑸若称取样品3.00g,加入5mL 10.0mol/L的硫酸,产生无色气体,排入量筒中液体的体积为229mL(标准状况)。对获得准确的气体体积无益的操作有__________(填序号)。
①检查装置的气密性;
②连通乙、丁的导管要预先注满水;
③读数时视线与量筒内凹液面最低点相平;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平;
⑤在甲装置胶塞上再连接一个导管,通入N2将系统中SO2全部排出。
⑹向逸出气体后的溶液中加入稍过量的BaCl2溶液,过滤、洗涤、干燥,得到白色沉淀13.98g。根据实验所得现象及数据,可知:样品中Na2SO3的质量分数是____________,含有的杂质是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com