
| A. | H2O、H2S、H2Se | B. | Hg、Na、NaCl | ||
| C. | 晶体硅、金刚石、碳化硅 | D. | S、Br2、O3 |
分析 首先判断晶体的类型,一般来说晶体的熔点原子晶体>离子晶体>金属晶体>分子晶体,相同晶体从影响晶体熔沸点高低的因素分析:
原子晶体中,晶体的熔点与键长成反比,键长越长,晶体的熔点越低;
离子晶体中,结构相似的离子晶体,离子半径越小,晶格能越大,熔点越高;
金属晶体中,原子半径依次越小,金属离子电荷越多,金属键就越强强,则熔点就越高;
分子晶体中,结构相似,分子量越大,熔沸点越高,含有氢键的物质熔沸点较高.
解答 解:A.从两个角度考虑,水中存在氢键,沸点最高,H2Se和H2S结构相似,分子间只存在范德华力,相对分子质量越大,沸点越高,故正确顺序为H2O>H2Se>H2S,故A错误;
B.晶体熔沸点高低顺序一般为:原子晶体>离子晶体>分子晶体,氯化钠属于离子晶体、Hg、Na属于金属晶体,Hg常温下为液态,所以熔沸点由高到低的顺序是:金刚石NaCl>Na>Hg,故B错误;
C.金刚石、碳化硅、晶体硅都是原子晶体,且原子间键长大小顺序是硅硅键>碳硅键>碳碳键,所以这三种晶体熔点由高到低的顺序是:金刚石>碳化硅>晶体硅,故C错误;
D.S、Br2、O3都属于分子晶体,都不含有氢键,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,硫有S2、S4、S8等,相对分子质量较大,硫单质常温下为固体,Br2式量160,常温下为液体,O3式量48,常温下为气体,所以熔点由高到低S、Br2、O3,故D正确;
故选D.
点评 本题考查晶体熔点的比较,题目难度不大,注意把握影响不同晶体熔沸点高低的因素,当然也可以依据物质在常温下的状态来比较,学习中注重相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液 | B. | H+浓度为1×10-6 mol/L的溶液 | ||
| C. | pH<7的溶液 | D. | c(OH-)<c(H+)的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 438.6 kJ/mol | B. | 241.8 kJ/mol | C. | 285.8kJ/mol | D. | -285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 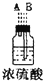 | 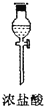 |  | 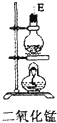 | 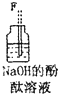 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的粒子一定不带电,胶体中的分散质粒子带电荷 | |
| B. | 电泳现象证明胶体带电荷 | |
| C. | 加入电解质,胶体可产生沉淀,而溶液不能 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现光亮的通路,前者则没有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com