
【题目】在无色透明的溶液中,下列各组离子能大量共存的是( )
A. K+、H+、SO42- 、C1- B. Na+、CO32-、NO3-、Ca2+
C. Na+、NH4+、OH-、Cl- D. Na+、SO42-、Cu2+、C1-
科目:高中化学 来源: 题型:
【题目】下表中金属的冶炼原理与方法完全正确的是:( )
选项 | 方法 | 冶炼原理 |
A | 湿法炼铜 | CuSO4+2K= Cu+K2SO4 |
B | 热分解法炼铜 | Cu2S+O2 |
C | 电解法炼铝 | 2Al2O3(熔融) |
D | 热还原法冶炼钡 | BaO+H2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化氮的下列说法中不正确的是( )
A.二氧化氮是一种红棕色气体
B.二氧化氮是造成酸雨的气体之一
C.二氧化氮易溶于水,不能用排水法收集
D.氮气与氧气反应可直接生成二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )

A. 500 mL 2.0 mol·L-1HCl溶液和500 mL 2.0 mol·L-1NaOH溶液的反应符合图(a),且放出热量为ΔE1
B. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C. 发生图(a)能量变化的任何反应,一定不需要加热即可发生
D. CaO、浓硫酸分别溶于水时的能量变化均符合图(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.通常,同周期元素的第一电离能ⅦA族的元素最大
B.主族元素的原子形成单原子离子时的化合价数都和它的族序数相等
C.第ⅠA、ⅡA族元素的原子,其半径越大,第一电离能越大
D.在同一主族中,自上而下第一电离能逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:
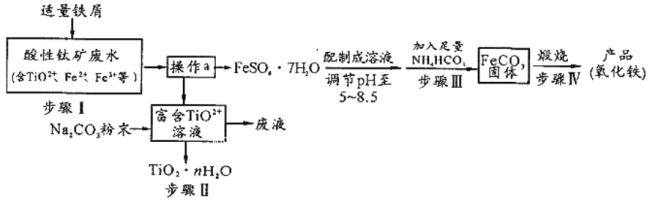
已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________________。
(2)步骤Ⅰ中检验钛矿废水中加入铁屑是否足量的试剂是________________________。
(3)操作a是蒸发浓缩、冷却结晶、______________________________________________。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5, c(Fe2+) = 1×10-6mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
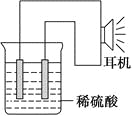
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素R、X、Y、Z、T。R与T原子最外层电子数均是电子层数的2倍;Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点:Y < X
C. T、R的最高价氧化物对应的水化物的酸性T比R的强
D. Y分别与T、X组成的二元化合物的水溶液一定是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com