
【题目】室温下,用0.10mol/L CH3 COOH溶液滴定10.00mL浓度均为0.10 mol/L NaOH和NH3·H2O的混合液,混合溶液的相对导电能力随乙酸滴入的变化曲线如下图所示。已知:Ka(CH3COOH)=1. 8×10-5,Kb( NH3·H2O) =1. 8× l0-5。下列叙述错误的是
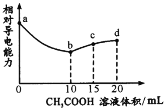
A.ab段为CH3COOH与NaOH的中和过程
B.b点水的电离程度最大
C.c点3c(Na+)=2c(CH3 COOH)+2c(CH3 COO-)
D.d点c(Na+)>c(NH![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
【答案】B
【解析】
由Ka(CH3COOH)=1. 8×10-5、Kb( NH3·H2O) =1. 8× l0-5可知,在室温下,两种弱电解质的电离常数相同。
A. 由图中信息可知,ab段溶液的导电能力逐渐减弱至最低,说明在此过程中,溶液中的离子总浓度逐渐减小,只是CH3COOH与NaOH的中和过程,NaOH是强碱,其完全电离,故其先参与中和反应,NH3·H2O是弱碱,其没有参加反应,因为只要NH3·H2O参加反应就会生成可溶性的强电解质醋酸铵,离子总浓度必然增大,A叙述正确;
B. b点为醋酸钠和NH3·H2O的混合液,此时NH3·H2O的电离抑制了水的电离,在d点恰好完成所有的中和反应,溶液中只有醋酸钠和醋酸铵两种溶质,两者的水解均促进水的电离,故d点水的电离程度最大,B叙述错误;
C.由于起始状态时醋酸和氢氧化钠的物质的量浓度相同,在c点,醋酸的体积是原氢氧化钠溶液体积的1.5倍,根据物料守恒可知,3c(Na+)=2c(CH3 COOH)+2c(CH3 COO-),C叙述正确;
D. 在室温下,两种弱电解质的电离常数相同。在d点溶液中只有醋酸钠和醋酸铵,且两者物质的量浓度相同。若醋酸根离子的物质的量浓度与铵根离子浓度相同,则溶液呈中性,但是,此时溶液中醋酸根离子的物质的量浓度是铵根离子的2倍,因此,醋酸根离子的水解作用大于铵根离子的水解作用,溶液呈碱性,因此,c(Na+)>c(NH![]() )>c(OH-)>c(H+),D叙述正确。
)>c(OH-)>c(H+),D叙述正确。
本题选B。


科目:高中化学 来源: 题型:
【题目】乙酸丁酯的物理性质如表。
乙酸 | 1-丁醇 | 乙酸丁酯 | |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
实验室用如图所示的实验装置制取乙酸丁酯。
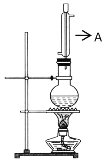
(1)仪器A的名称___。
(2)写出制取乙酸丁酯的化学方程式:__。
(3)该实验中生成物除了主产物乙酸丁酯外,还可能生成的有机副产物有__(写出一种结构简式)。
(4)酯化反应是一个可逆反应,为提高1-丁醇的转化率,可采取的措施是__(写出两条)。
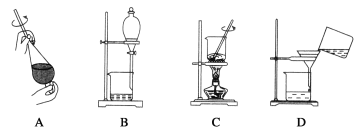
(5)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,需要的是__(填答案编号)。
(6)用60g乙酸与37g1-丁醇反应,实验中得到乙酸丁酯的质量为40.6g,则乙酸丁酯的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
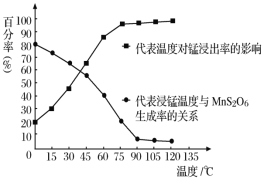
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如图:
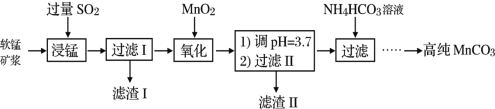
(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有___(写一条。)
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO![]() +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___。
(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___(填离子符号)。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___。
(5)写出“氧化”过程中MnO2与SO2反应的化学方程式___。
(6)滤渣Ⅱ是___(填化学式)。
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的富集与转化是当今环境研究的热点。
(1)化石燃料的燃烧是使大气CO2浓度增加的原因之一。汽油中含有辛烷(C8H18),1molC8H18(l)完全燃烧生成CO2(g)和H2O(l),放出5518kJ热量。写出C8H18完全燃烧的热化学方程式:__。
(2)一种富集CO2的过程如图所示。
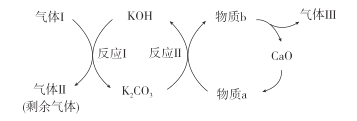
①气体Ⅰ、Ⅱ、Ⅲ中,CO2浓度最高的是___。
②反应Ⅱ的化学方程式是__。
(3)一定条件下,CO2和H2反应能生成C2H4,实现CO2向能源物质的转化。
已知:2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH<0
①上述反应的ΔH可根据C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)和__反应的焓变计算。
②研究温度和压强对CO2的平衡转化率的影响,结果如图所示。
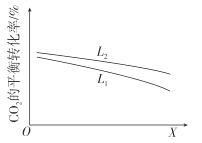
X代表的物理量是__。比较L1与L2的大小,并说明依据__。
③相同条件下,CO2和H2还能发生其它反应:
反应a:CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
反应b:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
……
Fe和Co(钴)可作为该反应的催化剂。改变铁钴的物质的量比,测定相同时间内CO2的消耗率和含碳产物的占比,结果如下:
n(Fe):n(Co) | CO2消耗率/% | 含碳产物占比/% | ||
CO | C2H4 | CH4 | ||
100:0 | 1.1 | 100 | 0 | 0 |
50:50 | 30.5 | 36.8 | 20.3 | 42.9 |
0:100 | 69.2 | 2.7 | 0.2 | 97.1 |
结合数据,推测催化剂中钴的作用:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图所示装置测定水中氢氧元素之比。下列说法错误的是

A.①、③、④中依次盛装无水CaCl2、碱石灰、碱石灰
B.需测定实验前后装置②和装置③的质量差
C.结束反应时,应先移走酒精灯,待装置②的玻璃管冷至室温,再关闭活塞K
D.实验后装置②的玻璃管中CuO未全部变红,对实验结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产。气相直接合成的反应为:C2H4(g)+H2O(g)![]() C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
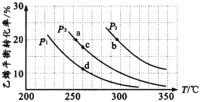
(l)P2时,若起始n(H2O)=n(C2H4)=lmol,容器体积为1L,反应经5 min达到a点,在0~5 min时段,反应速率v(C2H5OH)为____mol/(Lmin),a点的平衡常数Ka=______(保留两位小数)。
(2)乙烯气相直接水合反应的ΔH____0(填“>”或“<”),相同起始量达到a、b所需要的时间ta__tb(填“>”、“<”或“=”,后同)。c、d两点的平衡常数Kc____Kd。
(3)300℃时,要提高乙烯的平衡转化率可采取的措施有______、______ 、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干种。某同学为确定该固体粉末的成分,取X进行如下实验,实验过程及现象如图所示。该同学得出的结论不正确的是( )

已知:Cu2O+2H+=Cu2++Cu+H2O
A.根据现象1无法推出固体粉末中是否含有NaNO3
B.根据现象2可推出白色沉淀是BaSO4
C.根据现象3可推出固体粉末中一定含有K2SO3
D.根据现象4可推出固体粉末中的氧化物只有FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是一种治疗缺血性脑卒药物,其合成路线如下:
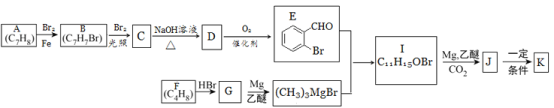
已知:ⅰ.有机物K是一种酯,分子中除苯环外还含有1个五元环;
ⅱ.R—Br ![]() RMgBr
RMgBr 
回答下列问题:
(1)有机物B的名称为________,D的含氧官能团的名称是______。
(2)F→G的反应类型为_____。
(3)J的结构简式为______,K的分子式为_____。
(4)E与银铵溶液反应的化学方程式为______。
(5)已知B在一定条件下可以水解生成X,与X互为同分异构体且含有苯环的有机物有_____种(不含X自身),写出其中核磁共振氢谱有4组吸收峰,且峰值比为3:2:2:1的结构简式____(任写一种)。
(6)利用题中信息所学知识,写出以甲烷和苯甲醛为原料,合成苯乙烯的路线流程图(其他试剂自选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
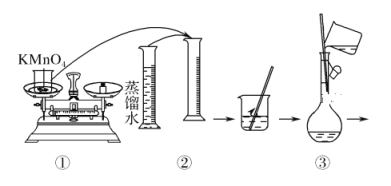
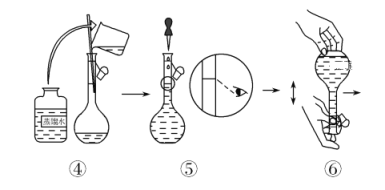
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com