
【题目】马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2 , 还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图: 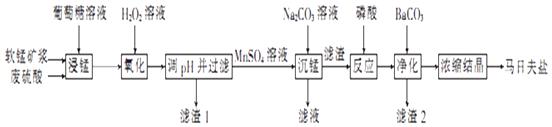
(1)软锰矿要先制成矿浆的目的是 , 葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为 .
(2)用H2O2溶液“氧化”时发生反应的列子方程式为 .
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为 , 滤渣1的主要成分为(填化学式).
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为 .
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐t.
【答案】
(1)增大反应物接触面积,加快反应速率,提高原料利用率;12:1
(2)2Fe2++H2O2+2H+═2Fe3++2H2O
(3)5.0~7.8; Fe(OH)3和Al(OH)3
(4)MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O
(5)2.5935
【解析】解:(1)为增大反应物接触面积,加快反应速率,提高原料利用率,软锰矿要先制成矿浆;葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,则反应为:12MnO2+C6H12O6+24H2SO4=12MnSO4+6CO2↑+18H2O,二氧化锰为氧化剂,葡萄糖为还原剂,故反应中氧化剂与还原剂的物质的量之比为12:1;
所以答案是:增大反应物接触面积,加快反应速率,提高原料利用率;12:1;(2)过氧化氢溶液氧化Fe2+为Fe3+,反应为:2Fe2++H2O2+2H+═2Fe3++2H2O;
所以答案是:2Fe2++H2O2+2H+═2Fe3++2H2O;(3)调节pH沉淀Fe3+、Al3+,但不能沉淀Mn2+,由表可知,调节pH为5.0~7.8,可以达到目的,故滤渣1为Fe(OH)3和Al(OH)3;
所以答案是:5.0~7.8;Fe(OH)3和Al(OH)3;(4)MnCO3沉淀与磷酸反应为MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O;
所以答案是:MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O;(5)软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,设得到马日夫盐质量为x,根据锰元素质量守恒,则有 ![]() ×1t×87%×91%=
×1t×87%×91%= ![]() ×x,解得x=2.5935;
×x,解得x=2.5935;
所以答案是:2.5935.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的.已知: (a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期.
(b)W由B、C组成,分子中原子个数比为B:C=1:2,固体易升华.
(c)X由A、C组成,分子中原子个数比为A:C=1:1.
(d)Y由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C:D=1:1.
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子数之比为1:2.
试回答下列各小题:
(1)各元素符号:ABCDE
(2)W的电子式: .
(3)X的结构式: .
(4)Y的电子式: .
(5)Z的化学式: .
(6)写出Y与水反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中的事实与“温度对化学反应速率影响”有关的是( )
A.夏天的食物比冬天的食物腐败变质更快
B.锅炉房里粉末状的煤比块状的煤燃烧得更快更旺
C.汽车加大油门跑得更快
D.充满N2的塑料密封袋保存的薯片保质期更长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 催化剂能够降低化学反应的反应热
B. 己知C(s)+O2(g)=CO2(g) △H1;C(s)+ 1/2O2(g)=CO(g) △H2。则△H1>△H2
C. 已知中和热为ΔH=-57.3 kJ·mol-1,则H2SO4(aq)与Ba(OH)2(aq)反应生成2moIH2O(l) ΔH=-114.6 kJ·mol-1
D. 甲烷的燃烧热为ΔH=-890.3 kJ·mol-1,1g 水蒸气转化为液态水放热2.4444kJ, 则lgCH4完全燃烧生成气态水放出的热量为50.14kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图装置的叙述,正确的是( ) 
A.镁片为负极,镁片上产生黄绿色气体
B.铁片为阳极,铁片上产生无色气体
C.溶液中铁片与镁片之间产生白色沉淀
D.溶液的pH将逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的主要过程中:
(1)反应N2(g)+3H2(g)2NH3(g)△H<0;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡,图1图象能正确表示该过程中相关量的变化的是 . (选填字母). 
(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ![]() ,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
(3)2NO(g)+O2(g)2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图2). ①比较P1、P2的大小关系:P1P2(填“>”、“<”或“=”).
②随温度升高,该反应平衡常数变化的趋势是 .
(4)硝酸厂常用如下2种方法处理尾气. ①催化还原法:催化剂存在时用H2将NO2还原为N2 .
已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2 . 若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱完全中和时( )
A.酸和碱的物质的量一定相等
B.酸所提供的H+与碱提供的OH﹣的物质的量相等
C.酸和碱的物质的量浓度相等
D.溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4) :
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。某同学进行实验,实验装置如图。其中A、B的成分见表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
② | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
③ | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该反应的离子方程式为_____________________________,实验结束后读数前需要移动量气管,使两个量气管的液面相平。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率。为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/mL | 10 | 5 | 0 | X |
0.5mol/LH2C2O4/mL | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
时间/S | 40 | 20 | 10 | ______ |
(2) X=______,4号实验中始终没有观察到溶液褪色,你认为可能的原因是________________。
(3)2号反应中,H2C2O4的反应速率为_____________。
(4)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间/S | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
结合实验目的与表中数据,你得出的结论是_______________________。
(5)从影响化学反应速率的因素看,你的猜想还可能是______________的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是_________。
a.硫酸钾 b.水 c.二氧化锰 d.硫酸锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH ![]() CH3CH2CH2CHO 利用如图装置用正丁醇合成正丁醛.相关数据如表:
CH3CH2CH2CHO 利用如图装置用正丁醇合成正丁醛.相关数据如表:
物质 | 沸点/℃ | 密度/(gcm﹣3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )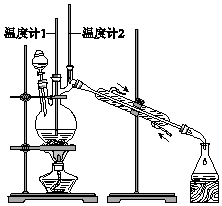
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com