
【题目】关于如图装置的叙述,正确的是( ) 
A.镁片为负极,镁片上产生黄绿色气体
B.铁片为阳极,铁片上产生无色气体
C.溶液中铁片与镁片之间产生白色沉淀
D.溶液的pH将逐渐增大
【答案】C
【解析】解:该装置是原电池,镁片作负极,铁片作正极,
A.镁片为负极,负极上镁失电子发生氧化反应生成镁离子,故A错误;
B.铁片作正极,正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为:2H2O+O2+4e﹣=4OH﹣ , 故B错误;
C.负极上的电极反应式为:2Mg﹣4e﹣=2Mg 2+ , 正极上的电极反应式为:2H2O+O2+4e﹣=4 OH﹣ , 镁离子和氢氧根离子反应生成难溶性的氢氧化镁,故C正确;
D.由负极上的电极反应式为:2Mg﹣4e﹣=2Mg 2+ , 正极上的电极反应式为:2H2O+O2+4e﹣=4 OH﹣ , 所以总反应为2Mg+2H2O+O2=2Mg(OH)2↓,所以溶液的pH基本不变,故D错误;
故选C.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题:

(1)铁元素位于元素周期表中第四周期__________族。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是氢原子的最外层电子“饱和缺一”。请写出LiH的电子式_____________,而且Li+的离子半径比H-_______(填“大”或“小”)。
(3)d的某化合物呈淡黄色,可与硫酸亚铁溶液反应生成红褐色沉绽和能使带火星的木条复燃的气体,d的该化合物中含有的化学键类型为__________________。
(4)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带______(填“正”或“负”)电荷。
(5)下列叙述正确的是______
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.氢化物的酸性:f弱于g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关原电池的工作原理中的下列说法中不正确的是( )
A.电池负极发生氧化反应
B.电池正极发生还原反应
C.电子流向是从负极流向正极(外电路)
D.电流方向是从负极流向正极(外电路)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列框图分析,下列说法正确的是( ) 
A.E2+的氧化性比M2+的氧化性强
B.在③反应中加稀硫酸可抑制Fe2+的水解
C.反应④的离子方程式可表示为:E3++3SCN﹣E(SCN)3↓
D.在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马日夫盐是一种白色晶体,易溶于水,常用于机械设备的磷化处理.以软锰矿(主要成分为MnO2 , 还含有少量的Fe2O3、FeO和Al2O3)为原料制备马日夫盐的流程如图: 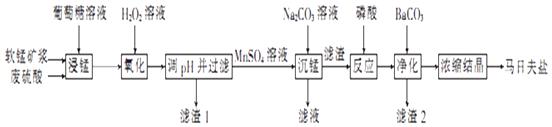
(1)软锰矿要先制成矿浆的目的是 , 葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为 .
(2)用H2O2溶液“氧化”时发生反应的列子方程式为 .
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表所示、“调pH并过滤”时,应调整的pH范围为 , 滤渣1的主要成分为(填化学式).
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为 .
(5)某工厂用上述流程制备马日夫盐,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1t该软锰矿可制得马日夫盐t.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中p轨道上有3个未成对电子的元素符号: , 某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4 , 该元素的名称是 .
(2)根据价层电子对互斥理论推测下列离子或分子的空间立体构型:H3O+ , BF3 .
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关反应的离子方程式、 .
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是
A.青菜中含有维生素C
B.维生素C具有还原性
C.致人中毒过程中砷发生还原反应
D.砒霜是氧化产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com