
【题目】![]() 的生产、应用是一个国家化工水平的重要标志。
的生产、应用是一个国家化工水平的重要标志。
(1)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:
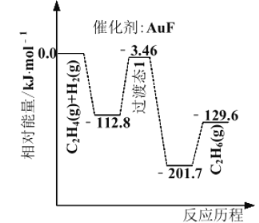
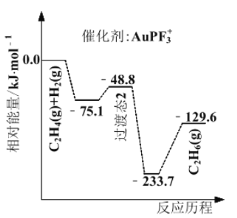
则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 经催化加氢合成乙烯:
经催化加氢合成乙烯:![]() 。恒容条件下,按
。恒容条件下,按![]() 投料,各物质平衡浓度变化与温度的关系如图所示:
投料,各物质平衡浓度变化与温度的关系如图所示:
①指出图中曲线![]() 分别表示_______、________的浓度。
分别表示_______、________的浓度。
②升高温度,平衡常数![]() _________(“减小”“增大”或“不变”)。
_________(“减小”“增大”或“不变”)。![]() 点,
点,![]() ______(用
______(用![]() 表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。
表示)。写出能提高乙烯平衡产率的措施__________(任举两种)。

(3)加州理工学院Theodor Agape等在强碱环境下,实现了电催化![]() 制
制![]() ,产物的选择性高达
,产物的选择性高达![]() ,
,![]() 转化为
转化为![]() 的电极反应式为___________________。
的电极反应式为___________________。
【答案】![]()
![]()
![]()
![]() 减小
减小 ![]() 加压、适当降温、移走产物
加压、适当降温、移走产物 ![]()
【解析】
(1)![]() 与反应过程无关,只与反应的始态与终态有关,所以
与反应过程无关,只与反应的始态与终态有关,所以![]() ,根据图像可知,催化乙烯加氢效果较好的催化剂是
,根据图像可知,催化乙烯加氢效果较好的催化剂是![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)①该反应的正反应为放热反应,升高温度,平衡逆向移动,水蒸气和乙烯都减少,根据反应方程式,水蒸气比乙烯减少的快,由图可知,m和n减少,且m减少的快,则m为水蒸气,n为乙烯,同理,二氧化碳和氢气都增多,氢气增多的比二氧化碳快,a和b都是增多,a增多的快,a为氢气,b为二氧化碳,故答案为:![]() ;
;![]() ;
;
②该反应的正反应为放热反应,升高温度,平衡逆向移动,升高温度,平衡常数减小,恒容条件下,设CO2的浓度为1xmol/L,H2浓度为3xmol/L,则
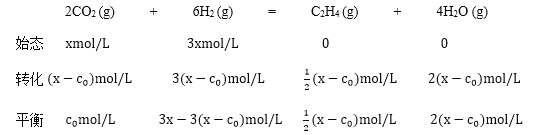
在A点,CO2的浓度等于H2O的浓度,c0=2(x-c0),x=![]() c0,K=
c0,K=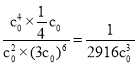 ,该反应为气体分子数减小的反应,增大压强,平衡正向移动,乙烯平衡产率提高;又因为该反应正反应为放热反应,降低温度,平衡正向移动,乙烯平衡产率提高;移走产物,平衡正向移动,乙烯平衡产率提高,故答案为:减小;
,该反应为气体分子数减小的反应,增大压强,平衡正向移动,乙烯平衡产率提高;又因为该反应正反应为放热反应,降低温度,平衡正向移动,乙烯平衡产率提高;移走产物,平衡正向移动,乙烯平衡产率提高,故答案为:减小;![]() ;加压、适当降温、移走产物;
;加压、适当降温、移走产物;
(3)![]() 在碱性条件下,得到电子,发生还原反应,其电极反应式为:
在碱性条件下,得到电子,发生还原反应,其电极反应式为: ![]() ,故答案为:
,故答案为:![]() 。
。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n;
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有c(Ba2+)= c(SO42-)=![]()
③将0.1mol·L-1的NaHS和0.1mol·L-1Na2S溶液等体积混合,所得溶液中有c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A.①④B.②③C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。
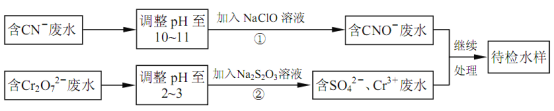
完成下列填空:
(1)HCN有剧毒,电子式是___,其分子属于___(填“极性”、“非极性”)分子。
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:___,氮原子核外有___种能量不同的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___。
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:___。
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为___个。
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请计算(写出计算过程):
(1)混合气体中NO和NO2的体积各位多少?______________
(2)被还原的硝酸的物质的量为多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.5 mol·L1CH3COONa溶液、0.5 mol·L1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是

A. 随温度升高,纯水中c(H+)>c(OH)
B. 随温度升高,CH3COONa溶液的c(OH)减小
C. 随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D. 随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO、Cu2+水解平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,某溶液X中所含ClO2浓度(g·L-1)的实验测定步骤如下:步骤1. 配制Na2S2O3溶液:准确称取1.984 0 g Na2S2O3·5H2O,用新煮沸并冷却的蒸馏水配成100.00 mL溶液。步骤2. 准确移取1.00 mL溶液X加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+===5I2+2Cl-+4H2O),在暗处放置5 min。步骤3. 向步骤2的锥形瓶的反应液中加入1 mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3===2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液25.00 mL。
(1)步骤1中所配Na2S2O3溶液的物质的量浓度为____mol·L-1,所用玻璃仪器除烧杯、胶头滴管外还有____。(2)配制Na2S2O3溶液时,蒸馏水需煮沸的原因是____。
(3)计算溶液X中所含ClO2浓度(g·L-1)(写出计算过程)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com