
【题目】为探究不含结晶水盐A(仅含三种元素)组成和性质,设计并完成如下实验:①取少量A,加水,A由白色变为蓝色,加热蓝色又变成白色;②另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,C能使盐酸酸化的BaCl2溶液产生白色沉淀。B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水。
(1)A组成元素是_____(用元素符号表示)。
(2)B的化学式是______。
(3)B与水反应的化学方程式是______。
【答案】Cu S O Cu2OSO4 ![]() 或
或![]() 或
或![]()
【解析】
少量A,加水,A由白色变为蓝色,加热蓝色又变成白色,这是硫酸铜晶体吸水和脱水的现象,说明A是CuSO4;另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,那么有B的质量为![]() =120,C的质量为
=120,C的质量为![]() =40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒可确定B的化学式;B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水,根据原子守恒可确定方程式。
=40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒可确定B的化学式;B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水,根据原子守恒可确定方程式。
(1)少量A,加水,A由白色变为蓝色,加热蓝色又变成白色,这是硫酸铜晶体吸水和脱水的现象,说明A是CuSO4,含有的元素是Cu、S、O;
(2)另取一定量A进行加热分解,加热分解过程中有黄色中间产物B产生,同时产生气体C,B的质量为A质量的四分之三,那么有B的质量为![]() =120,C的质量为
=120,C的质量为![]() =40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒有: 2CuSO4=SO3+2CuOSO3,B的化学式为Cu2OSO4;
=40;C能使盐酸酸化的BaCl2溶液产生白色沉淀,说明C为SO3,根据原子守恒有: 2CuSO4=SO3+2CuOSO3,B的化学式为Cu2OSO4;
(3)B遇水生成不溶于水的蓝色固体D,同时有三分之二的SO42-溶于水,根据原子守恒有3Cu2OSO4+3H2O=3Cu(OH)2CuSO4+2CuSO4或者3Cu2OSO4+4H2O=3Cu(OH)2CuSO4H2O+2CuSO4或者3Cu2OSO4+3H2O=Cu4(OH)6SO4H2O+2CuSO4。


科目:高中化学 来源: 题型:
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组查阅资料得知:保险粉(Na2S2O4)和KOH的混合溶液能定量吸收O2:CuCl的盐酸溶液能定量吸收CO,且易被O2氧化。拟设计实验方案,采用上述两种溶液和KOH溶液及量气装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。下列说法不正确的是

A. 采用上述3种吸收剂,气体被逐一吸收的顺序应该是CO2、O2和CO
B. 保险粉(Na2S2O4)和KOH的混合溶液吸收O2的离子方程式为2S2O42-+3O2+4OH-=4SO42-+2H2O
C. 反应结束,恢复至室温,调整水准管内液面与量气管液面齐平,可观察到量气管液面下降
D. 其他两种吸收剂不变,O2的吸收剂可以用灼热的铜网替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃X在标況下的密度1.25g/L,液态烃A摩尔质量为106g/mol,C是油脂皂化反应后的产物之一,具吸水保湿功能,D是有芳香气味的酯。它们之间的转化如下图所示(含有相同官能团的有机物通常具有相似的化学性质)
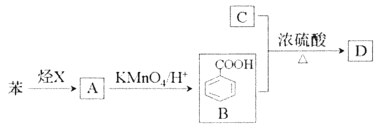
请回答
(1)烃X所含官能团的名称是_______。
(2)A→B的反应类型是_________。
(3)B与C按3:1反应生成D的化学方程式为_______。
(4)下列说法正确的是_______。
A.邻二溴苯只有一种结构,证明苯环结构中不存在单双键交替结构
B.上述六种有机物都能与H2发生加成反应
C.可用新制Cu(OH)2鉴别B、C、D
D.相同质量的苯与苯甲酸充分燃烧消耗等量的O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下一系列转化关系,回答问题。已知:H是具有水果香味的液体,I的产量作为衡量一个国家的石油化学工业发展水平的标志,J为高分子化合物。

(1)A、B的名称分别是___、_____; D、F 的化学式为___________;I的结构简式______;
(2)写出化学方程式并指出反应类型:
C→E _____________,反应类型:____________。
G→H _______,反应类型:_______。
I→J _________________,反应类型:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有如下δ、γ、α三种晶体结构,三种晶体在不同温度下能发生转化。下列说法不正确的是( )
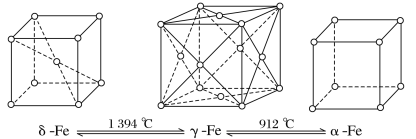
A.δ、γ、α三种晶体互为同分异构体
B.αFe晶体中与每个铁原子等距离且最近的铁原子有6个
C.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型不同,化学性质相同
D.γFe晶体为面心立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
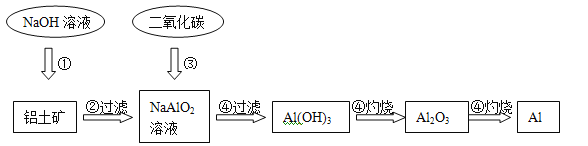
(1)请用离子方程式表示以上工艺流程中第①步反应:__ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:_ _____。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途_____________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨在工业生产中具有重要意义。
(1)在合成氨工业中I2O5常用于定量测定CO的含量。己知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为____________________________________。
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ (CO2)随时间t变化曲线如图。

①温度T1时,0~0.5 min内的反应速率v(CO)=________________。
②b点CO的平衡转化率α为____________,c点的平衡常数K为________________。
③下列措施能提高该反应CO转化率的是________(填字母)
a.升高温度 b.增大压强 c.加入催化剂 d.移走CO2
(3)若氨水与SO2恰好生成正盐,则此时溶液呈_________(填“酸性”或“碱性”),向上述溶液中通入___________(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为________________。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1,H2SO3的Ka1=1.5×10-2mol·L-1,Ka2=6.3×10-8mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com