
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以废治废、变废为宝可以实现资源的综合利用。用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠,转化关系如图所示:

(1)A溶液中一定含有的溶质是_______。
(2)若使③中水解程度变大,可采取的措施是_______(填字母序号)。
a.加热 b.加入NaHCO3 c.加入NH4Cl
(3)写出③中水解生成Fe2(OH) m Cl6-m反应的化学方程式:______。
(4)将废铁块进行预处理制成电极,通过电解制备高铁酸钠,该装置原理示意图如图所示。铁块做_______(填“阳极”或“阴极”),对应的电极反应式为_______。

(5)高铁酸钠在水中缓慢产生红褐色沉淀和一种气体,该反应的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,甲为0.1mol/L的醋酸溶液,乙为0.5mol/L的醋酸溶液。下列说法正确的是
A. 溶液的导电能力:甲=乙 B. 醋酸的电离转化率:甲 >乙
C. 对水的电离的抑制程度:甲 >乙 D. c(CH3COO-):甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,把0.5mol/L的HF溶液加水稀释,随着加水量的增大,下列判断正确的是
A. 溶液中F-的个数减小 B. 电离平衡常数ka值变大
C. 电离转化率不变 D. c(F- )/c(HF)此比值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)漂白粉溶液在空气中放置失效,发生反应的离子方程式:_______________________。
(2)次氯酸的电离方程式:______________________________________。
(3)氯化铁溶液与单质铜反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列实验事实所引出的相应结论正确的是 ( )
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
C | 物质的量浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 如下图所示,50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在装置中进行中和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
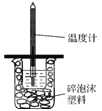
(1)图中装置缺少的仪器是 _______________。
(2)下列说法不正确的是________________ (填序号)。
A.若用50mL 0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL 0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B.用标准溶液润洗滴定管2-3次;
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
E.调节液面至0或0刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___________________.
(2)实验中眼睛注视_____________,直至滴定终点。判断到达终点的现象是___________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL,则c(HCl)=______。
(4)下列操作中,可能造成测定结果偏高的是________________。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com