
【题目】以废治废、变废为宝可以实现资源的综合利用。用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠,转化关系如图所示:

(1)A溶液中一定含有的溶质是_______。
(2)若使③中水解程度变大,可采取的措施是_______(填字母序号)。
a.加热 b.加入NaHCO3 c.加入NH4Cl
(3)写出③中水解生成Fe2(OH) m Cl6-m反应的化学方程式:______。
(4)将废铁块进行预处理制成电极,通过电解制备高铁酸钠,该装置原理示意图如图所示。铁块做_______(填“阳极”或“阴极”),对应的电极反应式为_______。

(5)高铁酸钠在水中缓慢产生红褐色沉淀和一种气体,该反应的离子方程式:_______。
【答案】FeCl2 a b 2FeCl3 + mH2O ![]() Fe2(OH) mCl6-m + mHCl 阳极 Fe - 6e- + 8OH - === FeO42- + 4H2O 4FeO42-+10H2O === 4Fe(OH)3↓ + 3O2↑ + 8OH-(Fe2O3或水合物,合理正确)
Fe2(OH) mCl6-m + mHCl 阳极 Fe - 6e- + 8OH - === FeO42- + 4H2O 4FeO42-+10H2O === 4Fe(OH)3↓ + 3O2↑ + 8OH-(Fe2O3或水合物,合理正确)
【解析】
(1)废铁快与盐酸反应:Fe+2HCl=FeCl2+H2↑,即A溶液中一定含有的溶质为FeCl2;
(2)a、A溶液被氧化,即FeCl2被氧化成FeCl3,FeCl3发生水解,水解是吸热反应,即加热促进Fe3+水解,故a正确;
b、加入NaHCO3,Fe3+与HCO3-发生双水解反应,促进Fe3+水解,故b正确;
c、加入NH4Cl,NH4+水解生成H+,
抑制Fe3+水解,水解程度降低,故c错误;
(3)根据聚合氯化铁的化学式,生成聚合氯化铁的化学反应方程式为2FeCl3 + mH2O ![]() Fe2(OH) mCl6-m + mHCl;
Fe2(OH) mCl6-m + mHCl;
(4)根据实验目的,制备高铁酸钠,Fe应失去电子转化成FeO42-,Fe的化合价升高,根据电解原理,铁作阳极,环境为碱性,阳极反应式为Fe+8OH--6e-=FeO42-+4H2O;
(5)红褐色沉淀为Fe(OH)3,Fe元素化合价降低,氧元素的化合价升高,即气体为O2,该反应的离子方程式为 4FeO42-+10H2O = 4Fe(OH)3↓ + 3O2↑ + 8OH-。


科目:高中化学 来源: 题型:
【题目】二次污染是排入环境中的一次污染物在物理、化学或生物因素的作用下发生变化,或与环境中的其他物质发生反应,生成新的污染物。下列物质①SO2、②NO、③NO2、④HCl、⑤CO2,不易导致二次污染的是( )
A.①②③④⑤B.①③⑤C.④⑤D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花中能提取出有很高的药用价值的绿原酸(如图),下列说法错误的是

A.1 mol绿原酸与足量溴水反应,最多消耗4 mol Br2
B.绿原酸能发生取代、加成、消去和氧化反应
C.1 mol绿原酸与足量Na反应生成气体在标况下的体积为33.6L
D.绿原酸水解的一种产物能与FeCl3发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1![]() ,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1![]() ,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业中都有着广泛的应用。实验室通过下图所示的流程由Mn2O3氧化甲苯制备苯甲醛,试回答下列问题。
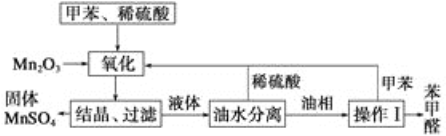
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的是______。
(3)实验过程中,可循环使用的物质有__________。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是___,其原理是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
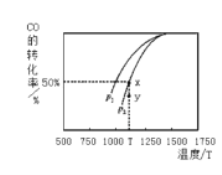
【题目】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2 (g) ![]() CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图所示。

(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______(选填“增大”、“减小”或“不变”)。
(2)由下图可知该反应的△H_____0(选填“>”、“<”或“=”,下同),压强pl____p2;当压强为p2时,在y点:v(正)____v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车(标志为“![]() ”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
”)在改善城市交通、保护环境等方面的作用至关重要。下列说法不正确的是
A. 电动汽车的使用有助于减少氮氧化物的排放
B. 燃油汽车也可以悬挂该标志
C. 电动汽车使用时涉及化学能与电能的转换
D. 电动汽车充电、放电过程均有电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com