
【题目】下列物质转化关系如图所示,已知A为中学化学常见的非金属单质固体,E为常见的金属单质,反应过程中部分产物略去。

(1)写出棕黄色溶液中溶质的化学式 。
(2)写出B→C的化学反应方程式 。
(3)写出F→H在酸性溶液中发生的离子反应方程式 。
【答案】 (6分)(1)FeCl3、 Fe2(SO4)3 (2)2SO2+O2 ![]() 2SO3
2SO3
(3)2Fe2+ + H2O2 + 2H+= 2Fe3+ + 2H2O
【解析】
试题分析:A为常见的非金属固体单质,E为常见的金属单质,溶液F和氯水反应得到棕黄色溶液说明生成的是三价铁盐溶液,沉淀G为Fe(OH)3,溶解于酸D生成溶液H,和金属E反应又生成F判断金属具有变价,F为低价金属的盐溶液为亚铁盐溶液,则推断D和金属E腐蚀反应、生成低价亚铁盐溶液,酸D为H2SO4,A为S,B为SO2,C为SO3,D为H2SO4;
(1)棕黄色溶液中所含溶质的化学式为FeCl3、 Fe2(SO4)3。
(2)B→C的化学反应方程式为2SO2+O2 ![]() 2SO3 。
2SO3 。
(3)Fe2+在酸性溶液中被过氧化氢氧化发生的离子反应方程式为2Fe2+ + H2O2 + 2H+= 2Fe3+ + 2H2O。


科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,分子中含有8个原子,1mol该有机物含有46mol质子.完全燃烧该有机物在相同条件下测定CO2和水蒸气体积比为2:1。取2.7g该有机物恰好与30mL 1mol/L的碳酸钠溶液完全反应。(请写出必要的计算过程)求:
(1)有机物分子式;
(2)有机物结构简式.
(3)写出该有机物在一定条件下与乙二醇反应生成六元环状化合物的方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修5:有机化学基础]氰基丙烯酸酯在碱性条件下能快速聚合为![]() ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
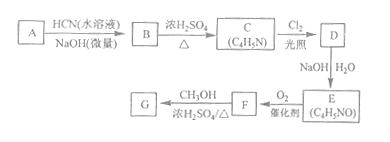
已知:①A的相对分子量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为___________。
(5)G中的官能团有___、 ____ 、_____。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
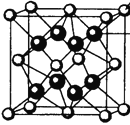
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大麻酚及它的衍生物都属麻醉药品,并且毒性较强。吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中。吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高。大麻酚分子结构为
回答下列问题:

(1)大麻酚的分子式为__________。
(2)写出大麻酚燃烧的化学方程式:_________________。
(3)大麻酚属酚类化合物,写出大麻酚与NaOH及足量溴水的反应产物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修3:物质结构与性质】 碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有 种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
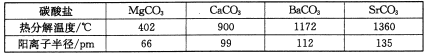
试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
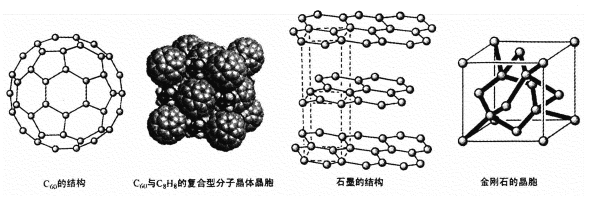
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
(6)碳的第三种同素异形体—一金刚石,其晶胞如上图所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如下图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图 (从A~D图中选填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:
。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I、打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体;铁粉与水蒸气在高温下也可生成该黑色固体,
(1)反应的化学方程式为 。
(2)将该黑色固体溶于盐酸中,反应的离子反应方程式 。
II、某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl 2 +H 2 ↑外,其他可能反应的离子方程式为 。
(2)若将③该加H2O2 书写离子反应方程式 。
(3)若溶液B中只含有Fe 2+ 而不含Fe 3+ ,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B、②③ C、③④ D、①④
(4)步骤④化学方程式为 。
(5)若除去氯化铜中氯化铁可以加入剂 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com