
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s电子的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是① ,X和Y中电负性较大的是 ② (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
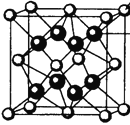
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是_________(填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
【答案】
(1)①1s22s22p63s1或[Ne]3s1 ②Cl
(2)H2S分子间不存在氢键,H2O分子间存在氢键
(3)平面三角形
(4)Na+
(5)K2Cr2O7+3H2O2+ 4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O
【解析】
试题分析:根据题意知M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层p轨道数是s轨道电子数的2倍,则M是O元素;R是同周期元素中最活泼的金属元素,则R是Na元素;X和M形成的一种化合物是形成酸雨的主要大气污染物,则X是S元素,Y为Cl元素;Z的基态原子4s和3d轨道半充满,即价电子排布式为3d54s1,Z是Cr元素,据此作答。
(1)R是Na元素,原子序数为11,根据构造原理确定其基态原子的电子排布式为1s22s22p63s1或[Ne]3s1;S和Cl比较电负性较大的是Cl元素,答案为:1s22s22p63s1;Cl。
(2)H2S的沸点低于H2O的主要原因是水分子间形成氢键,使水的沸点升高,答案为:H2S分子间不存在氢键,H2O分子间存在氢键。
(3)SO3中硫原子的价层电子对为3+(6-3×2)/2=3,没有孤电子对,硫原子的杂化方式为sp2,该分子的空间构型为平面三角形,答案为:平面三角形。
(4)根据晶胞结构可以算出白球的个数为![]() ,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+,答案为:Na+。
,黑球的个数为8个,由于这种离子化合物的化学式为Na2O,黑球代表的是Na+,答案为:Na+。
(5)根据题意知重铬酸钾被还原为Cr3+,则过氧化氢被氧化生成氧气,利用化合价升降法配平,反应的化学方程式为:K2Cr2O7+3H2O2+ 4H2SO4=== K2SO4+Cr2(SO4)3+3O2↑+7H2O ,
答案为:K2Cr2O7+3H2O2+ 4H2SO4=== K2SO4+Cr2(SO4)3+3O2↑+7H2O 。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇分子官能团名称是_______________。
(2)试管a中加入几块碎瓷片的目的是___________。
(3)试管a中发生反应的化学方程式为 ___________,反应类型是_______。
(4)可用_________的方法把制得的乙酸乙酯分离出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:

回答下列问题:
(1)A的化学名称为_____由A生成B的反应类型为_____。
(2)C的结构简式为_____。
(3)富马酸的结构简式为_____。
(4)检验富血铁中是否含有Fe3+的实验操作步骤是_____。
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出____L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有____________(写出结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为4种短周期元素。已知:①X、W同主族,Y、Z同主族;②X、Y可形成两种液态化合物X2Y和X2Y2;③X2Z和ZY2之间可发生反应生成Z单质;④W2Y2和X2Y之间可发生反应生成Y单质。
请完成下列问题:
(1)X、Y元素的名称为X________,Y________。
(2)写出W2Y2的电子式:__________,Z的原子结构示意图为__________。
(3)写出④ 中反应的化学方程式__ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种合金当环境温度远小于其转变温度时,可以随便改变它的形状,当达到转变温度时,会恢复其原来面貌,具有这种效应的合金为( )
A.超导金属 B.形状记忆金属 C.储氢金属 D.光纤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu 64)。
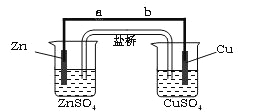
按照实验步骤依次回答下列问题:
(1)导线中电子流向为 (用a、b 表示)。
(2) 写出装置中锌电极上的电极反应式: ;
(3)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;(不许用“NA”表示 )
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+,Cl-的移动方向描述正确的是 。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(5)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B.Zn C.Fe D.H2SO4
(6)反应一段时间后右侧烧杯中Cu2+浓度是 (填增大 减小或不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化关系如图所示,已知A为中学化学常见的非金属单质固体,E为常见的金属单质,反应过程中部分产物略去。

(1)写出棕黄色溶液中溶质的化学式 。
(2)写出B→C的化学反应方程式 。
(3)写出F→H在酸性溶液中发生的离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题

(1)写出合成乙酸乙酯的化学方程式____________________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 ___________________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com