
【题目】A、B、C、D、E、F是原子序数依次增大的六种常见元素,其中A原子最外层电子数比次外层电子数多2个电子;B的阴离子与C的阳离子电子数之和为20,质子数相差3;E2、EB2均是生活生产中常见的杀菌消毒剂;气体DB2中D的质量分数为50%;A与F形成一种化合物M可与水反应生成一种可燃性的直线型分子N。根据以上信息回答下列问题:
(1)用一个反应方程式说明D与E的非金属性强弱关系___________________________。
(2)M的电子式___________________________________________________。
(3)汽车安仝气囊中的叠氮化钠NaN3可用次氯酸钠溶液销毁,写出反应的化学方程式:______________________,每生成1molN2,转移的电子数为_____________________________。
(4)自来水厂常用EB2对饮用水进行杀菌消毒,处理后的水中要求EB2的残留的浓度为![]() ,一般可用碘量法对其进行检测,现操作步骤如下:
,一般可用碘量法对其进行检测,现操作步骤如下:
Ⅰ、取1L水样加硫酸酸化,向其中加入足量的KI溶液,充分反应后,用NaOH溶液调节溶液至中性,加入淀粉溶液。
Ⅱ、用![]() 溶液滴定Ⅰ所得溶液,测得所用体积为
溶液滴定Ⅰ所得溶液,测得所用体积为![]()
①步骤Ⅰ中EB2与碘化钾溶液反应的离子方程式为___________________________________。
②滴定终点的现象_________________________________________________________。
③步骤Ⅰ中调节溶液至中性的原因是________________________________________。
④该水样中EB2的浓度为______________________________mg/L。(保留到小数点后两位)
【答案】![]() 或
或![]()
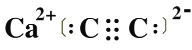
![]()
![]()
![]() 溶液由蓝色变为无色,半分钟内不恢复为蓝色
溶液由蓝色变为无色,半分钟内不恢复为蓝色 ![]() 在酸性条件下反应/歧化反应;I2在碱性条件下反应/歧化反应 0.71
在酸性条件下反应/歧化反应;I2在碱性条件下反应/歧化反应 0.71
【解析】
A原子最外层电子数比次外层电子数多2个电子,所以A为C;B的阴离子与C的阳离子电子数之和为20,质子数相差3,则B为O,C为Na;气体DB2中D的质量分数为50%,则D为S;A、B、C、D、E、F是原子序数依次增大的六种常见元素,E2、EB2均是生活生产中常见的杀菌消毒剂,则E为Cl; A与F形成一种化合物M可与水反应生成一种可燃性的直线型分子N,则F为Ca,以此分析解答。
(1)根据上述分析可知:D为S,E为Cl,根据非金属间的置换反应可以证明非金属性强弱,如![]() ,说明非金属性S<Cl,答案:
,说明非金属性S<Cl,答案:![]() ;
;
(2) 根据上述分析可知:A为C,F为Ca,A与F形成一种化合物M为CaC2,其电子式![]() ;答案:
;答案:![]() ;
;
(3)汽车安仝气囊中的叠氮化钠NaN3可和次氯酸钠溶液发生氧化还原反应生成氮气、氯化钠和水,反应的化学方程式为:![]() ,由2NaN3
,由2NaN3![]() 2
2![]() 2e-mol,则每生成1molN2,转移的电子数为
2e-mol,则每生成1molN2,转移的电子数为![]() ,
,![]() :
:![]() ;
;![]() ;
;
(4) ①根据上述分析可知:EB2为ClO2,用于自来水厂杀菌消毒剂,ClO2与碘化钾溶液发生氧化还原反应,I-被氧化为I2,ClO2被还原Cl-,其离子方程式为![]() ;答案:
;答案:![]() ;
;
②根据![]() 反应原理可知滴定终点的现象是:溶液由蓝色变为无色,半分钟内不恢复为蓝色,答案:溶液由蓝色变为无色,半分钟内不恢复为蓝色;
反应原理可知滴定终点的现象是:溶液由蓝色变为无色,半分钟内不恢复为蓝色,答案:溶液由蓝色变为无色,半分钟内不恢复为蓝色;
③因为![]() 在酸性条件下反应歧化反应,所以步骤Ⅰ中需将溶液调节至中性,答案:
在酸性条件下反应歧化反应,所以步骤Ⅰ中需将溶液调节至中性,答案:![]() 在酸性条件下反应歧化反应;
在酸性条件下反应歧化反应;
④根据![]() 和
和![]() 反应可知:
反应可知:
2ClO2![]() I2
I2![]() S2O32-,n(ClO2)=0.0025
S2O32-,n(ClO2)=0.0025![]() 0.021
0.021![]() ;c(ClO2)=
;c(ClO2)=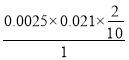 =1.05
=1.05![]() 10-5mol/L=1.05
10-5mol/L=1.05![]() 10-5mol
10-5mol![]() 67.5g/mol=7.1
67.5g/mol=7.1![]() 10-4g/mol=0.71 mg/L,答案:0.71。
10-4g/mol=0.71 mg/L,答案:0.71。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向溴水中加入足量的乙醛溶液,可以看到溴水褪色,对产生该现象的原因有如下三种猜想:①溴水与乙醛发生取代反应;②由于乙醛分子中有不饱和键,溴水与乙醛发生加成反应;③由于乙醛具有还原性,溴水将乙醛氧化为乙酸。为探究哪种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性;
方案二:测定反应前溴水中 Br2 的物质的量和反应后溶液中 Br—离子的物质的量。
(1)方案一是否可行__________填(“是”或“否”),理由是____________________。
(2)假设测得反应前溴水中 Br2 的物质的量为 amol,
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生取代反应;
若测得反应后 n(Br-)=__________mol,则说明溴水与乙醛发生加成反应;
若测得反应后 n(Br-)=__________mol,则说明溴水将乙醛氧化为乙酸。
(3)按物质的量之比为 1︰5 配制 1000mLKBrO3-KBr 溶液,该溶液在酸性条件下完全反应可生成 0.5molBr2。取该溶液 10mL 加入足量乙醛溶液,使其褪色,然后将所得溶液稀释为 100mL,准确量取其中 10mL,加入过量的 AgNO3 溶液,过滤、洗涤、干燥后称量得到固体 0.188g。若已知 CH3COOAg 易溶于水,试通过计算判断溴水与乙醛发生反应的类型为__________(选填猜想序号)。
(4)写出上述测定过程中的三个反应的离子方程式:
①KBrO3 和KBr 在酸性条件下的反应:______________________________;
②溴水与乙醛的反应:______________________________;
③测定 Br-离子含量的反应:______________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:

回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯( )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油等化石燃料对促进经济社会发展起到了重要的作用,这些燃料合理的综合利用是当前节能减排的要求。请回答下列问题:
(1)石油分馏是石油炼制的重要环节,这种操作是在_______(填设备名称)内完成的。工业上通常使用的分馏石油的方法有常压分馏和_____,分馏的目的是___________。
(2)石油不仅是重要的燃料,还是重要的化工原料的来源,如利用石油生产乙烯。为了使石油分馏产物进一步生成更多的乙烯、丙烯等短链烃而采取______措施。
(3)目前石油资源逐渐匮乏,人们把目光聚集到储量相对丰富的煤上。目前煤综合利用的主要方法是________________、________和煤的气化,煤气化涉及的化学方程式有:C+O2![]() CO2 2C+O2
CO2 2C+O2![]() 2CO _____________(写出第三个化学方程式)。
2CO _____________(写出第三个化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 。向物质的量浓度相同的
。向物质的量浓度相同的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液产生
溶液产生![]() 、
、![]() 两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。
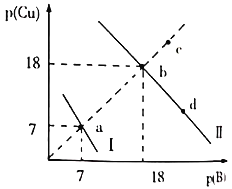
图中的![]() ,
,![]() 或
或![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.曲线Ⅰ表示的是Cu2+与OH-浓度关系的曲线
B.该温度下,![]()
C.升高温度时,b点会向c点移动
D.向d点对应的溶液中加入对应阴离子的钠盐固体,d点向b点移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 ,分析其结构,并回答下列问题:
,分析其结构,并回答下列问题:
(1)写出其分子式:____________________________________________。
(2)其中含有____个不饱和碳原子,分子中有____个双键。
(3)分子中的极性键有__________(写出2种即可)。
(4)分子中的饱和碳原子有______个,一定与苯环处于同一平面的碳原子有______个。
(5)分子中C—C===O键角约为__________,H—C≡C键角约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
根据K的变化,结合已有知识推测,随着卤素原子核电荷数的降低,下列说法不正确的是
A.在相同条件下,平衡时X2的转化率逐渐升高
B.X2与H2反应的剧烈程度逐渐减弱
C.HX的还原性逐渐减弱
D.HX的生成为放热反应,由此可知t1<t2
查看答案和解析>>
科目:高中化学 来源: 题型:
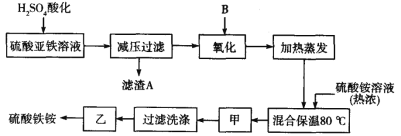
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
请回答下列问题:
(1)硫酸亚铁溶液加 H2SO4 酸化的主要目的是____________,滤渣 A的主要成分是______________。
(2)下列物质中最适合的氧化剂 B 是____________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲_____________,乙_____________。
(4)上述流程中,有一处不严密,请指出并修改_____________。
(5)检验硫酸铁铵中NH4+的方法是_____________。
(6)称取 14.00 g 样品,将其溶于水配制成 100 mL 溶液,并分成两等份,向其中一份 中加入足量 NaOH 溶液,过滤洗涤得到 2.14 g 沉淀;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应。则该硫酸铁铵的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1) 互为同分异构体。_________
互为同分异构体。_________
(2)烯烃分子中所有原子都在同一平面上_________
(3)既可以用溴水鉴别甲烷和乙烯,又可以用溴水除去甲烷中的乙烯。_________
(4)煤中含有芳香烃,可以通过干馏的方法得到芳香烃。_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com