
【题目】A是烃的含氧衍生物,能发生以下变化:
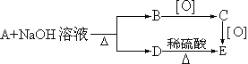
现知12克B与足量金属钠反应,在标准状况下放出2.24升氢气,试写出各物质的结构简式___________。
【答案】A为CH3CH2COOCH2CH2CH3;B为CH3CH2CH2OH;C为CH3CH2CHO;D为CH3CH2COONa,E为CH3CH2COOH。
【解析】
A是烃的含氧衍生物,能与NaOH溶液反应,则A应为酯类,在NaOH溶液中水解生成羧酸钠和醇,据图可知B被氧化可生成C,C被氧化生成E,A水解生成的某物质酸化也生成E,则D为羧酸钠、E为羧酸、C为醛、B为醇;又因A水解只生成B、D两种物质,所以E应为一元酸,B为一元醇;现知12克B与足量金属钠反应,在标准状况下放出2.24升氢气,即0.1mol氢气,所以12gB的物质的量应为0.2mol,所以B的式量为60,则B中C原子数为![]() ,所以B的分子式为C3H7O,因其能被氧化成醛,所以B的结构简式为CH3CH2CH2OH,被催化氧化生成的醛C为CH3CH2CHO,C被氧化生成的羧酸为CH3CH2COOH,则D为CH3CH2COONa,CH3CH2COOH与CH3CH2CH2OH酯化生成的酯为CH3CH2COOCH2CH2CH3。
,所以B的分子式为C3H7O,因其能被氧化成醛,所以B的结构简式为CH3CH2CH2OH,被催化氧化生成的醛C为CH3CH2CHO,C被氧化生成的羧酸为CH3CH2COOH,则D为CH3CH2COONa,CH3CH2COOH与CH3CH2CH2OH酯化生成的酯为CH3CH2COOCH2CH2CH3。


科目:高中化学 来源: 题型:
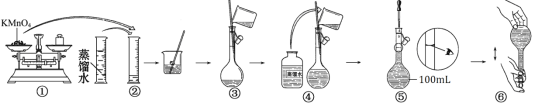
【题目】配制100 mL0.020mol/L KMnO4溶液的过程如下图所示:
回答下列问题:
(1)图示中有两步操作不正确,它们是_____和_____ (填序号)。
(2)操作⑤图示中的两种仪器分别是________、 __________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构如图所示,下列说法正确的是
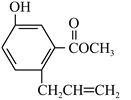
A. 1 mol X最多能与3 mol NaOH反应
B. X能与碳酸钠溶液产生二氧化碳
C. 1 mol X和浓溴水反应时,能消耗3 mol Br2
D. 1 mol X能最多能与5mol H2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的化工原料,用途很广。
![]() 合成氨工厂常用醋酸二氨合铜
合成氨工厂常用醋酸二氨合铜![]() 由
由![]() 和
和![]() 构成
构成![]() 溶液吸收对氨合成催化剂有毒害的CO气体。
溶液吸收对氨合成催化剂有毒害的CO气体。
![]() 醋酸二氨合铜所含的元素中,第一电离能最大的是 ______
醋酸二氨合铜所含的元素中,第一电离能最大的是 ______ ![]() 填元素名称
填元素名称![]() 。
。
![]() 醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______ ![]() 填标号
填标号![]() 。
。
![]() 离子晶体
离子晶体![]() 分子晶体
分子晶体![]() 原子晶体
原子晶体![]() 金属晶体
金属晶体
![]() 第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种![]() 不含
不含![]() 。
。
![]() 气体与
气体与![]() 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体:![]() 。
。
![]() 和
和![]() 分子的空间构型分别为 ______ 、 ______ 。
分子的空间构型分别为 ______ 、 ______ 。
![]() 晶体
晶体![]() 中,B原的杂化轨道类型为 ______ 。
中,B原的杂化轨道类型为 ______ 。
![]() 可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为![]() 的物质。该物质易溶于水,在水溶液中以
的物质。该物质易溶于水,在水溶液中以![]() 和
和![]() 两种正四面体构型的离子存在。
两种正四面体构型的离子存在。![]() 遇碱生成一种形似白磷的
遇碱生成一种形似白磷的![]() 分子。
分子。
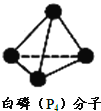
![]() 下列相关说法中,正确的是 ______
下列相关说法中,正确的是 ______ ![]() 填序号
填序号![]() 。
。
![]() 是
是![]() 的同分异构体
的同分异构体
![]()
![]() 分解生成
分解生成![]() ,形成了4mol
,形成了4mol![]() 键
键
![]() 白磷的沸点比
白磷的沸点比![]() 高,原因是
高,原因是![]() 键键能比
键键能比![]() 键大
键大
![]() 白磷的化学性质比
白磷的化学性质比![]() 活泼,说明P的非金属性比N强
活泼,说明P的非金属性比N强
![]() 画出
画出![]() 的结构
的结构![]() 标明其中的配位键
标明其中的配位键![]() : ______ 。
: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补充完成下表:(请把序号①~⑦的答案填在相应的位置上)
元素 | 甲 | 乙 | 丙 |
元素符号 | ①______ | ②______ | O |
原子结构示意图 |
| ③______ | ④______ |
周期 | 三 | 三 | ⑤______ |
族 | ⑥______ | ⅦA | ⑦______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。回答下列问题:
(1)装置中安全管的作用原理是___。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用___式滴定管,可使用的指示剂为___。
(3)样品中氨的质量分数表达式为___。

(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1,c(CrO42-)为___mol·L-1。
(已知:Ksp(Ag2CrO4)=1.12×10-12)
(6)X的化学为[Co(NH3)6]Cl3。制备X的反应化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com