
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成B的速率,与生成C的速率相等(数值)
D.单位时间消耗nmolA,同时生成2nmolC
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠![]() 是过氧化物类的消毒剂,可以利用候氏制碱法得到的
是过氧化物类的消毒剂,可以利用候氏制碱法得到的![]() ,进行制备,流程图如下:
,进行制备,流程图如下:
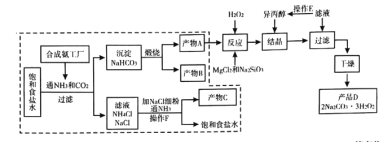
已知:①产物![]() 中可能含有少量的
中可能含有少量的![]() 、
、![]() 金属离子杂质。②硅酸钠可与
金属离子杂质。②硅酸钠可与![]() 、
、![]() 等高价金属离子形成沉淀。
等高价金属离子形成沉淀。
请回答下列问题:
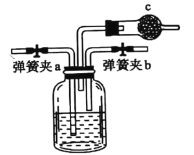
(1)虚线框中是侯氏制碱法的原理,某同学用右图装置在实验室模拟侯氏制碱法,实验中应先打开弹簧夹________(填![]() 或
或![]() ),通入________气体。
),通入________气体。
(2)索尔维制碱法是利用石灰石分解制备![]() ,并用生成的
,并用生成的![]() 和
和![]() 反应制备氨气,将
反应制备氨气,将![]() 和
和![]() 通人饱和食盐水制备
通人饱和食盐水制备![]() 晶体,分离提纯后分解制备纯碱。与索尔维制碱法相比,侯氏制碱法的优点是(至少写两点)________。
晶体,分离提纯后分解制备纯碱。与索尔维制碱法相比,侯氏制碱法的优点是(至少写两点)________。
(3)“反应”需控制温度在![]() 左右,写出“反应”中生成产品
左右,写出“反应”中生成产品![]() 的化学方程式________,加
的化学方程式________,加![]() 的作用是________。
的作用是________。
(4)流程图中可循环使用的物质有________。
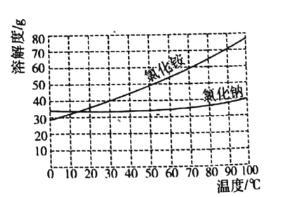
(5)操作![]() 的主要步骤有________(已知
的主要步骤有________(已知![]() 和
和![]() 的溶解度曲线如图所示)
的溶解度曲线如图所示)
(6)为了测定产品![]() 的纯度,某小组的方法是:取
的纯度,某小组的方法是:取![]() 产品配成
产品配成![]() 的溶液,取出
的溶液,取出![]() 用
用![]() 用硫酸酸化的
用硫酸酸化的![]() 溶液滴定至终点,该滴定过程中消耗高锰酸钾标准溶液的体积为
溶液滴定至终点,该滴定过程中消耗高锰酸钾标准溶液的体积为![]() 。产品的纯度为________%(用含有
。产品的纯度为________%(用含有![]() 和
和![]() 的式子表示)。
的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.用于新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
B.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
C.纳米级的钛白可由TiCl4水解制得:TiCl4+2H2O![]() TiO2+4HCl
TiO2+4HCl
D.被誉为“中国天眼”的射电望远镜,其“眼眶”的结构钢梁属于合金材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,进行如下实验:
①取100 mL上述溶液,加入足量氯化钡溶液,充分反应后将沉淀过滤、洗涤、干燥,得到4.30 g固体。向该固体中加过量的稀硝酸,仍有2.33 g固体未溶解。
②向①的滤液中加入足量NaOH,加热,产生使湿润的红色石蕊试纸变蓝的气体0.448 L(气体全部逸出,且已经换算成标准状况下体积)。以下说法正确的是
A.原溶液中SO42–、CO32–和NH4+一定存在,Cl-一定不存在
B.原溶液中一定不存在Ca2+,无法判断Na+是否存在
C.原溶液中可能存在Cl-,且c(Na+) ≥ 0.200 mol· L-1
D.为确定原溶液中Cl-是否存在,可以取实验①的滤液,加硝酸酸化的AgNO3进行检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有以下六种物质:①乙醇 ②![]() 溶液 ③
溶液 ③![]() 固体 ④液态氯化氢 ⑤纯
固体 ④液态氯化氢 ⑤纯![]() ⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
(2)![]() 和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
(3)配平下列化学方程式,在横线上填写化学计量数。
_________![]() _________
_________![]() _________
_________![]() =_________
=_________![]() _________
_________![]() _________
_________![]()
(4)已知反应:![]() ,当反应生成2.40gBr2时,电子转移的数目为____________。
,当反应生成2.40gBr2时,电子转移的数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化锰![]() 可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
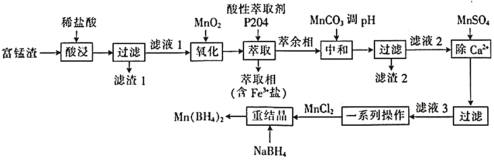
已知几种氢氧化物的Ksp 的值如下表:
氢氧化物 |
|
|
|
|
Ksp |
|
|
|
|
请回答下列问题:
(1) NaBH4中B的化合价为________价。
(2)下列物质中与滤渣1不发生反应(高温或常温下)的是________(填字母)。
A.浓硝酸 B.氢氧化钠溶液 C.碳酸钠 D.氢氟酸
(3)“氧化”中发生反应的离子方程式为________________,该反应中氧化性:![]() ________(填“
________(填“![]() ”或“
”或“![]() ”) MnO2。
”) MnO2。
(4)“中和”时,调节pH约为________。(当溶液中的离子浓度小于![]() 时,沉淀达到完全,结果保留2位有效数字)
时,沉淀达到完全,结果保留2位有效数字)
(5) Mn(BH4)2能与稀盐酸反应生成H3BO3,该反应的化学方程式为________________。
(6)测定富锰渣中铁的含量:取20g富锰渣,经过上述“酸浸”“过滤”“氧化”“萃取”后,将萃取相(假设Fe3+span>全部被萃取)转入烧杯中,加入足量稀硫酸,充分反应后静置、分液,再向含Fe3+的溶液中加入足量KI,充分反应后,将溶液配制成500mL,取25mL于锥形瓶中并加入淀粉指示剂,最后用![]() 的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
实验次数 | 1 | 2 | 3 |
Na2S2O3标准液体积/ | 23.20 | 24.80 | 25.20 |
已知:I2+2Na2S2O3==2NaI+Na2S4O6
①滴定达到终点时溶液的颜色变化为________。
②富锰渣中铁的含量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
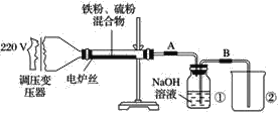
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com