
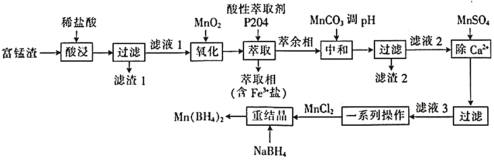
【题目】硼氢化锰![]() 可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
已知几种氢氧化物的Ksp 的值如下表:
氢氧化物 |
|
|
|
|
Ksp |
|
|
|
|
请回答下列问题:
(1) NaBH4中B的化合价为________价。
(2)下列物质中与滤渣1不发生反应(高温或常温下)的是________(填字母)。
A.浓硝酸 B.氢氧化钠溶液 C.碳酸钠 D.氢氟酸
(3)“氧化”中发生反应的离子方程式为________________,该反应中氧化性:![]() ________(填“
________(填“![]() ”或“
”或“![]() ”) MnO2。
”) MnO2。
(4)“中和”时,调节pH约为________。(当溶液中的离子浓度小于![]() 时,沉淀达到完全,结果保留2位有效数字)
时,沉淀达到完全,结果保留2位有效数字)
(5) Mn(BH4)2能与稀盐酸反应生成H3BO3,该反应的化学方程式为________________。
(6)测定富锰渣中铁的含量:取20g富锰渣,经过上述“酸浸”“过滤”“氧化”“萃取”后,将萃取相(假设Fe3+span>全部被萃取)转入烧杯中,加入足量稀硫酸,充分反应后静置、分液,再向含Fe3+的溶液中加入足量KI,充分反应后,将溶液配制成500mL,取25mL于锥形瓶中并加入淀粉指示剂,最后用![]() 的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
实验次数 | 1 | 2 | 3 |
Na2S2O3标准液体积/ | 23.20 | 24.80 | 25.20 |
已知:I2+2Na2S2O3==2NaI+Na2S4O6
①滴定达到终点时溶液的颜色变化为________。
②富锰渣中铁的含量为________。
【答案】+3 A MnO2+2Fe2++4H+==Mn2++2Fe3++2H2O < 4.7 Mn(BH4)2+2HCl+6H2O==MnCl2+8H2↑+2H3BO3 由蓝色变为浅绿色 14%
【解析】
富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)中加入稀盐酸,MnO、Al2O3、CaO、FeO都与盐酸反应,生成MnCl2、AlCl3、CaCl2、FeCl2(滤液1),只有SiO2不发生反应而成为滤渣1;滤液1中加入MnO2,发生反应MnO2+2Fe2++4H+==Mn2++2Fe3++2H2O;往氧化后的溶液中加入萃取剂,可将Fe3+萃取出来(进入萃取相),此时萃余相中含有MnCl2、AlCl3、CaCl2;加入MnCO3调pH,此时Al3+转化为Al(OH)3沉淀,过滤,所得滤渣2的成分为Al(OH)3,滤液2的成分为MnCl2、CaCl2;往滤液2中加入MnSO4,此时Ca2+转化为沉淀;将滤液3进行一系列操作,即得MnCl2,加入NaBH4重结晶,便可得到Mn(BH4)2。测定富锰渣中铁的含量时,需去除误差大的数据,取平均值,通过反应建立Fe3+与Na2S2O3的关系式,然后进行计算。
(1) NaBH4中,Na显+1价,H显-1价,则B的化合价为+3价。答案为:+3;
(2)A.浓硝酸具有酸性和强氧化性,与SiO2不能发生化学反应,A符合题意;
B.氢氧化钠溶液能与SiO2反应,生成硅酸钠和水,B不合题意;
C.碳酸钠能与SiO2在高温条件下发生反应,生成硅酸钠和CO2,C不合题意;
D.氢氟酸能与SiO2反应,生成四氟化硅和水,D不合题意;
故选A。答案为:A;
(3)“氧化”中,MnO2将Fe2+氧化生成Fe3+,自身被还原为Mn2+,发生反应的离子方程式为MnO2+2Fe2++4H+==Mn2++2Fe3++2H2O,该反应中MnO2是氧化剂,Fe3+是氧化产物,氧化性:![]() <MnO2。答案为:MnO2+2Fe2++4H+==Mn2++2Fe3++2H2O;<;
<MnO2。答案为:MnO2+2Fe2++4H+==Mn2++2Fe3++2H2O;<;
(4)“中和”时,1.0×10-5×c3(OH-)=1.0×10-33,c(OH-)=![]() mol/L,pOH=
mol/L,pOH=![]() ,pH=14-pOH≈4.7。
,pH=14-pOH≈4.7。
答案为:4.7;
(5) Mn(BH4)2能与稀盐酸发生氧化还原反应生成H2,同时生成MnCl2、H3BO3,该反应的化学方程式为Mn(BH4)2+2HCl+6H2O==MnCl2+8H2↑+2H3BO3。答案为:Mn(BH4)2+2HCl+6H2O==MnCl2+8H2↑+2H3BO3;
(6)①滴定前,原溶液中I2与淀粉结合所得溶液呈蓝色,反应后溶液呈Fe2+的颜色,所以达到终点时溶液的颜色变化为由蓝色变为浅绿色。
②在溶液中发生两个反应:2Fe3++2I-=2Fe2++I2、I2+2Na2S2O3==2NaI+Na2S4O6,由此可得出关系式:Fe3+——Na2S2O3,三次实验中,第一次实验误差大,取后两次实验的平均值,即得消耗V(Na2S2O3)=![]() =25.00mL,从而得出富锰渣中铁的含量为
=25.00mL,从而得出富锰渣中铁的含量为 =14%。
=14%。
答案为:由蓝色变为浅绿色;14%。


科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
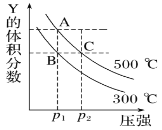
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成B的速率,与生成C的速率相等(数值)
D.单位时间消耗nmolA,同时生成2nmolC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
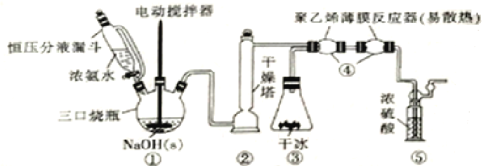
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可代替汽油作为汽车的燃料。已知101 kPa、常温下32 g甲醇完全燃烧放出736.3 kJ的热量,下列能正确表示甲醇标准燃烧热的热化学方程式的是
A.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=736.3 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=736.3 kJ·mol-1
B.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-736.3 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-736.3 kJ·mol-1
C.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 472.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________。
②CTCN的化学式为![]() ,与Co3+形成配位键的原子是________。(已知CO32的结构式为
,与Co3+形成配位键的原子是________。(已知CO32的结构式为![]() )
)
③![]() 可以
可以![]() (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,![]()
![]() 中含有σ键的物质的量为________。
中含有σ键的物质的量为________。
④![]() 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
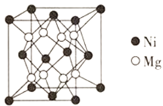
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________。
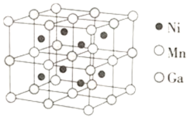
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________(列出计算表达式,NA表示阿伏加德罗常数的数值) gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学们在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如图所示,回答下列问题:
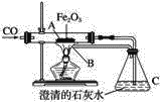
(1)写出用一氧化碳还原氧化铁的化学方程式_________,装置A中看到的现象是________。
(2)在C处看到的现象是_________,发生反应的化学方程式是________,说明反应后有________生成。
(3)本实验设计中,在B处所采取措施的目的是____________,其反应的化学方程式为__________。
(4)在给氧化铁加热时,要先通入一氧化碳气体后加热,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- |
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3![]() SiO2+H2O
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______,一定不存在的阴离子是________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
阴离子 | ①___ | ②___ | ||
c/mol·L-1 | ____ | ___ |
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com