
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________。
②CTCN的化学式为![]() ,与Co3+形成配位键的原子是________。(已知CO32的结构式为
,与Co3+形成配位键的原子是________。(已知CO32的结构式为![]() )
)
③![]() 可以
可以![]() (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,![]()
![]() 中含有σ键的物质的量为________。
中含有σ键的物质的量为________。
④![]() 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
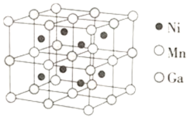
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________。
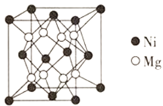
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________(列出计算表达式,NA表示阿伏加德罗常数的数值) gcm-3。
【答案】![]() (或
(或![]() ) Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备这种结构,因此Fe3+氧化性比Co3+弱 正四面体 N和O sp2、sp 9 mol N2H4与水可形成分子间氢键
) Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备这种结构,因此Fe3+氧化性比Co3+弱 正四面体 N和O sp2、sp 9 mol N2H4与水可形成分子间氢键 ![]()
![]()
【解析】
⑴基态Fe的核外电子排布式为[Ar]3d64s2,分析氧化性主要看Fe3+和Co3+的核外电子排布。
⑵①计算ClO4-价层电子对数;②有孤对电子才能与Co3+形成配位键;③逐个分析双聚氰胺中碳原子价层电子对数;④从相似相溶和分子间氢键角度思考配体N2H4能与水混溶。
⑶分别计算晶胞中Ni、Mn、Ga的个数。
⑷先根据氢气分子之间距离得出晶胞参数,再计算晶胞中Mg、Ni个数,再计算密度。
⑴Fe是26号元素,基态Fe的核外电子排布式为[Ar]3d64s2,基态Fe2+的核外电子排布式为[Ar]3d6。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备这种结构,因此Fe3+氧化性比Co3+弱;故答案为:[Ar]3d6;Fe3+的基态电子排布式为3d5,Co3+的基态电子排布式为3d6,Fe3+具有半充满结构,而Co3+不具备这种结构,因此Fe3+氧化性比Co3+弱。
⑵①ClO4-价层电子对数![]() ,其空间构型为正四面体形;故答案为:正四面体形。
,其空间构型为正四面体形;故答案为:正四面体形。
②CTCN中NH3的N有孤对电子,CO32的O有孤对电子,因此与Co3+形成配位键的原子是N、O;故答案为:N、O。
③双聚氰胺![]() 中第一个碳原子有3个σ键,无孤对电子,价层电子对数为3,杂化轨道为sp2,第二个碳原子有2个σ键,无孤对电子,价层电子对数为2,杂化轨道为sp,
中第一个碳原子有3个σ键,无孤对电子,价层电子对数为3,杂化轨道为sp2,第二个碳原子有2个σ键,无孤对电子,价层电子对数为2,杂化轨道为sp,![]()
![]() 中含有σ键的物质的量为9mol;故答案为:sp2、sp;9。
中含有σ键的物质的量为9mol;故答案为:sp2、sp;9。
④配体N2H4能与水混溶,除因为它们都是极性分子外,主要是因为N2H4与水形成分子间氢键;故答案为:N2H4与水可形成分子间氢键。
⑶晶胞中Ni在体内,共有8个,Mn在面心和顶点,个数为![]() ,Ga在棱心,个数为
,Ga在棱心,个数为![]() ,化学式可表示为Ni2MnGa;故答案为:Ni2MnGa。
,化学式可表示为Ni2MnGa;故答案为:Ni2MnGa。
⑷H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm,因此距离最近的两个H2分子之间是面对角线的一半,则晶胞参数为![]() nm,晶胞中Mg个数为8个,Ni为4个,则镍镁晶体未储氢时的密度为
nm,晶胞中Mg个数为8个,Ni为4个,则镍镁晶体未储氢时的密度为 ;故答案为:
;故答案为: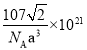 。
。


科目:高中化学 来源: 题型:
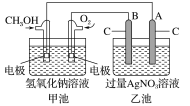
【题目】据报道,某种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用较长时间。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。
2K2CO3+6H2O。
请填空:
(1)充电时,①燃料电池的负极与电源________极相连。
②阳极的电极反应式为:________________________。
(2)放电时:负极的电极反应式为:__________________。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2____________L(标准状况)。
(4)若在常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定乙醇分子(C2H6O)中活泼氢原子个数,采用下列装置,通过测定乙醇与金属钠反应放出氢气的多少进行计算。
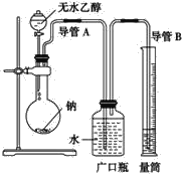
(1)指出实验装置中的错误:__。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将__(填“偏大”、“偏小”或“不变”)。
(3)请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化锰![]() 可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
可以用作储氢材料,也能用于科学研究。以富锰渣(含60% MnO,还含有SiO2、Al2O3、CaO、FeO)为原料制备硼氢化锰的工艺流程如下。
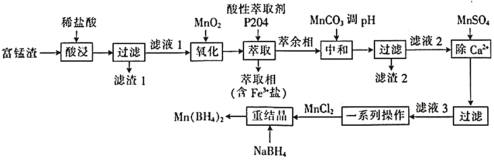
已知几种氢氧化物的Ksp 的值如下表:
氢氧化物 |
|
|
|
|
Ksp |
|
|
|
|
请回答下列问题:
(1) NaBH4中B的化合价为________价。
(2)下列物质中与滤渣1不发生反应(高温或常温下)的是________(填字母)。
A.浓硝酸 B.氢氧化钠溶液 C.碳酸钠 D.氢氟酸
(3)“氧化”中发生反应的离子方程式为________________,该反应中氧化性:![]() ________(填“
________(填“![]() ”或“
”或“![]() ”) MnO2。
”) MnO2。
(4)“中和”时,调节pH约为________。(当溶液中的离子浓度小于![]() 时,沉淀达到完全,结果保留2位有效数字)
时,沉淀达到完全,结果保留2位有效数字)
(5) Mn(BH4)2能与稀盐酸反应生成H3BO3,该反应的化学方程式为________________。
(6)测定富锰渣中铁的含量:取20g富锰渣,经过上述“酸浸”“过滤”“氧化”“萃取”后,将萃取相(假设Fe3+span>全部被萃取)转入烧杯中,加入足量稀硫酸,充分反应后静置、分液,再向含Fe3+的溶液中加入足量KI,充分反应后,将溶液配制成500mL,取25mL于锥形瓶中并加入淀粉指示剂,最后用![]() 的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
的Na2S2O3标准液滴定,进行三次平行实验,测得消耗Na2S2O3标准液的体积如表所示。
实验次数 | 1 | 2 | 3 |
Na2S2O3标准液体积/ | 23.20 | 24.80 | 25.20 |
已知:I2+2Na2S2O3==2NaI+Na2S4O6
①滴定达到终点时溶液的颜色变化为________。
②富锰渣中铁的含量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
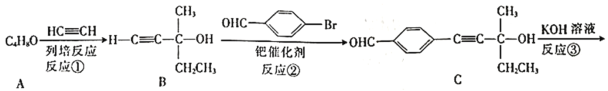
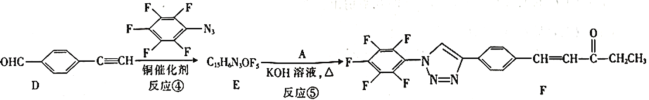
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:![]() +
+![]()
![]()
![]() 。我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如图所示:
。我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如图所示:
已知:![]() +
+
![]()
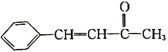 +H2O
+H2O
⑴A的名称是________。C中官能团的名称是________。
⑵反应④的反应类型为________。
⑶有机物分子中的1个碳原子上连接4个不同的原子或原子团时,该碳原子称为手性碳原子。上述流程中,存在手性碳原子的有机物有________(填字母)。
⑷反应③属于消去反应,反应③的化学方程式为________________。
⑸芳香族化合物G与C互为同分异构体,G的苯环上只有两个对位的取代基,且其中一个取代基为乙烯基(CH2=CH—)。G分子中只有两种官能团,且1molG与足量银氨溶液发生银镜反应生成4mol Ag,则G的结构有________种,其中核磁共振氢谱图中只有7组吸收峰的结构简式为________________(写出一种结构即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
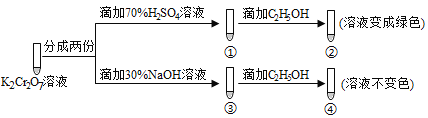
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com