
【题目】下列数据或事实所呈现的规律不能用元素周期律解释的是
A. B.
B.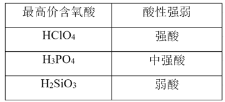
C.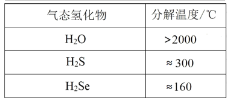 D.
D.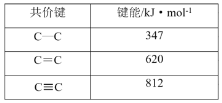
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。
⑴基态Fe2+的核外电子排布式为____。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:_____。
⑵BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为________。
②CTCN的化学式为![]() ,与Co3+形成配位键的原子是________。(已知CO32的结构式为
,与Co3+形成配位键的原子是________。(已知CO32的结构式为![]() )
)
③![]() 可以
可以![]() (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为________,![]()
![]() 中含有σ键的物质的量为________。
中含有σ键的物质的量为________。
④![]() 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为_____。
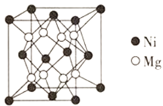
⑶一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为________。
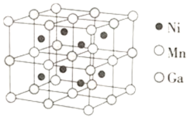
⑷镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为________(列出计算表达式,NA表示阿伏加德罗常数的数值) gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Br2常温下呈液态、易挥发、有毒。如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置。
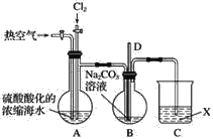
其实验步骤如下:
Ⅰ.在烧瓶中加入硫酸酸化的浓缩海水,持续通入Cl2一段时间,溶液变为浅棕色后,停止通入Cl2,改通入热空气;
Ⅱ.当A与B烧瓶溶液均变为无色的时候,停止通入热空气;
Ⅲ.将烧瓶B中的溶液倒入分液漏斗,加入稀硫酸酸化后,用CC14萃取,再经过蒸馏分离提取出其中的溴。
请回答:
(1)烧瓶A中通入Cl2过程中发生反应的离子方程式为_______________________。
(2)步骤Ⅰ中通入热空气的目的是_______________________。
(3)装置B中导管D的作用是____________________,装置C中的溶液X为____________。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,每生成1 mol Br2单质,转移的电子数为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.20℃时,饱和KCl溶液的密度为1.174 g·cm-3,质量分数为![]() ×100%,此溶液中KCl的物质的量浓度为4.0 mol·L-1
×100%,此溶液中KCl的物质的量浓度为4.0 mol·L-1
B.100g浓度为c mol·L-1的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积大于100ml(已知氨水的浓度越大,其密度越小)
C.将标准状况下的aLHCl气体溶于1000mL水中,得到的盐酸溶液密度为bg/mL,则该盐酸溶液的物质的量浓度为![]() mol/L
mol/L
D.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42—的物质的量浓度为![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- |
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3![]() SiO2+H2O
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______,一定不存在的阴离子是________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
阴离子 | ①___ | ②___ | ||
c/mol·L-1 | ____ | ___ |
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下CO2和H2S发生如下反应:CO2(g) +H2S(g)COS(g) +H2O(g)。有关实验数据如下:
实验 | 温度 | 物质的起始物质的量/(mol) | 平衡时COS物质的量/(mol) | |
n(CO2) | n(H2S) | n(COS) | ||
I | 337℃ | 0.10 | 0.40 | 0.01 |
II | 347℃ | 0.10 | 0.40 | 0.015 |
下列说法不正确的是
A.该反应为吸热反应
B.实验I达平衡后COS的物质的量分数为5%
C.实验I温度下,反应的平衡常数为![]()
D.平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,相同温度下再达平衡时n(COS)=0.03mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉和漂粉精是常用的消毒清洁用品,有效成分均为Ca(ClO)2,相应的生产流程如下。
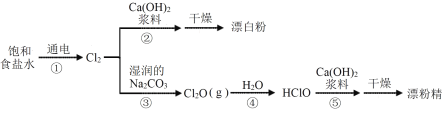
下列说法不正确的是
A.①中阳极的电极反应式为2Cl--2e-=Cl2↑
B.②中反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
C.上述过程涉及氧化还原反应、化合反应、复分解反应
D.制备漂粉精过程中,Cl2转化为Ca(ClO)2时,Cl的原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是
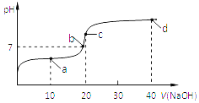
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+) = c(CH3COO-)
C. c点时:c(OH-) =c(CH3COOH) + c(H+)
D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com