
【题目】已知:Br2常温下呈液态、易挥发、有毒。如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置。
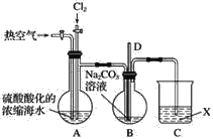
其实验步骤如下:
Ⅰ.在烧瓶中加入硫酸酸化的浓缩海水,持续通入Cl2一段时间,溶液变为浅棕色后,停止通入Cl2,改通入热空气;
Ⅱ.当A与B烧瓶溶液均变为无色的时候,停止通入热空气;
Ⅲ.将烧瓶B中的溶液倒入分液漏斗,加入稀硫酸酸化后,用CC14萃取,再经过蒸馏分离提取出其中的溴。
请回答:
(1)烧瓶A中通入Cl2过程中发生反应的离子方程式为_______________________。
(2)步骤Ⅰ中通入热空气的目的是_______________________。
(3)装置B中导管D的作用是____________________,装置C中的溶液X为____________。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,每生成1 mol Br2单质,转移的电子数为________mol。
【答案】Cl2+2Br-===2Cl-+Br2 使A中生成的Br2进入B瓶中 平衡压强、防止倒吸 NaOH溶液或Na2CO3溶液 ![]()
【解析】
(1)烧瓶A中通入Cl2过程中,发生氯气与海水中Br-的置换反应。
(2)步骤Ⅰ中通入热空气的目的是利用溴易挥发的性质,升高反应后海水的温度,让生成的溴单质气化进行装置内。
(3)装置B中导管D的作用是为了调节气压平衡,装置C中的溶液X是吸收未被前面装置吸收的气体。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,可从化合价升高或降价的某一种微粒进行分析。
(1)氯气和溴化钠反应生成溴和氯化钠,反应的离子方程式是Cl2+2Br-==2Cl-+Br2。答案为:Cl2+2Br-==2Cl-+Br2;
(2)由于溴单质易挥发,步骤Ⅰ中通入热空气的目的是使A中生成的Br2进入B瓶中。答案为:使A中生成的Br2进入B瓶中;
(3)B装置中导管D与大气相通,起到了平衡压强、防止倒吸的作用;尾气中含有有毒的氯气或溴,需要用碱液吸收,则X可以为NaOH溶液或Na2CO3溶液。答案为:平衡压强、防止倒吸;NaOH溶液或Na2CO3溶液;
(4)由方程式5Br-+BrO![]() +6H+==3Br2+3H2O,可从Br-分析,Br-中的Br由-1价升高到0价,5molBr-共失去5mole-,同时生成3molBr2,则每生成1 mol Br2单质,转移的电子数为
+6H+==3Br2+3H2O,可从Br-分析,Br-中的Br由-1价升高到0价,5molBr-共失去5mole-,同时生成3molBr2,则每生成1 mol Br2单质,转移的电子数为![]() mol。答案为:
mol。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
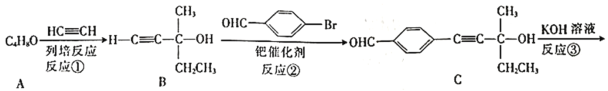
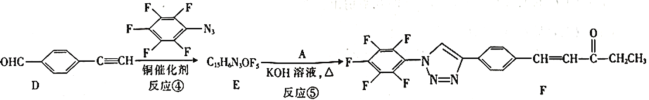
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:![]() +
+![]()
![]()
![]() 。我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如图所示:
。我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如图所示:
已知:![]() +
+
![]()
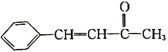 +H2O
+H2O
⑴A的名称是________。C中官能团的名称是________。
⑵反应④的反应类型为________。
⑶有机物分子中的1个碳原子上连接4个不同的原子或原子团时,该碳原子称为手性碳原子。上述流程中,存在手性碳原子的有机物有________(填字母)。
⑷反应③属于消去反应,反应③的化学方程式为________________。
⑸芳香族化合物G与C互为同分异构体,G的苯环上只有两个对位的取代基,且其中一个取代基为乙烯基(CH2=CH—)。G分子中只有两种官能团,且1molG与足量银氨溶液发生银镜反应生成4mol Ag,则G的结构有________种,其中核磁共振氢谱图中只有7组吸收峰的结构简式为________________(写出一种结构即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
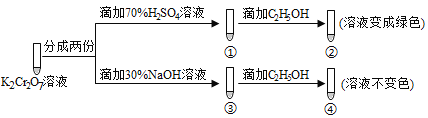
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
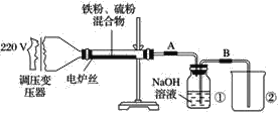
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g) ![]() CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(3)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
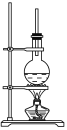
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com