
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
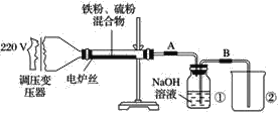
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
【答案】检查装置的气密性 Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全 不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂 不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果
【解析】
(1)密闭环境中发生反应前,都需检验装置是否漏气。
(2)关闭电源后,反应仍继续进行,说明反应能继续提供反应时所需的热量。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接,则会导致在反应结束、反应装置内压强减小时,产生倒吸。
(4)Fe2+ 具有较强的还原性,能被空气中的O2氧化为Fe3+。
(1)从以上分析可知,步骤(3)中缺少的实验操作是检查装置的气密性。答案为:检查装置的气密性;
(2)关闭电源后,反应仍继续进行,说明Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全。答案为:Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全;
(3)将盛有NaOH溶液的瓶中A、B导管位置反接,此操作不可以,因为若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。答案为:不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂;
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,他的说法不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。答案为:不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。


科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C的生成速率与C分解的速率相等
B.单位时间生成nmolA,同时生成3nmolB
C.单位时间生成B的速率,与生成C的速率相等(数值)
D.单位时间消耗nmolA,同时生成2nmolC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学们在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如图所示,回答下列问题:
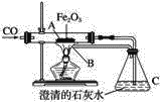
(1)写出用一氧化碳还原氧化铁的化学方程式_________,装置A中看到的现象是________。
(2)在C处看到的现象是_________,发生反应的化学方程式是________,说明反应后有________生成。
(3)本实验设计中,在B处所采取措施的目的是____________,其反应的化学方程式为__________。
(4)在给氧化铁加热时,要先通入一氧化碳气体后加热,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种物质中均含同种元素,且它们之间的转化关系如下。下列说法正确的是
![]()
A.A一定为单质
B.C一定为氧化物
C.D一定为酸
D.A、B、C的相对分子质量之差为16或16的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Br2常温下呈液态、易挥发、有毒。如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置。
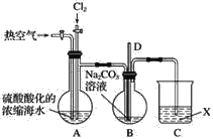
其实验步骤如下:
Ⅰ.在烧瓶中加入硫酸酸化的浓缩海水,持续通入Cl2一段时间,溶液变为浅棕色后,停止通入Cl2,改通入热空气;
Ⅱ.当A与B烧瓶溶液均变为无色的时候,停止通入热空气;
Ⅲ.将烧瓶B中的溶液倒入分液漏斗,加入稀硫酸酸化后,用CC14萃取,再经过蒸馏分离提取出其中的溴。
请回答:
(1)烧瓶A中通入Cl2过程中发生反应的离子方程式为_______________________。
(2)步骤Ⅰ中通入热空气的目的是_______________________。
(3)装置B中导管D的作用是____________________,装置C中的溶液X为____________。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,每生成1 mol Br2单质,转移的电子数为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
(1)制取合成气的反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)H =+206 kJ/mol。
CO(g)+3H2(g)H =+206 kJ/mol。
向体积为2 L密闭容器中,按n(H2O)∶n(CH4)=1投料:
a.保持温度为T1时,测得CH4(g)的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,CH4的转化率随反应温度的变化如图2所示。

①结合图1,写出反应达平衡的过程中的能量变化:______kJ。
②在图1中画出:起始条件相同,保持温度为T2(T2> T1)时, c(CH4)随时间的变化曲线______。
③根据图2判断:
ⅰ. a点所处的状态不是化学平衡状态,理由是_______。
ⅱ. CH4的转化率:c>b,原因是________。
(2)熔融碳酸盐燃料电池的结构示意图如下。

①电池工作时,熔融碳酸盐中CO32-移向________(填“电极A”或“电极B”)
②写出正极上的电极反应:________。
(3)若不考虑副反应,1 kg甲烷完全转化所得到的合成气全部用于燃料电池中,外电路通过的电子的物质的量最大为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Ag+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- |
提示:SiO32-+2H+=H2SiO3↓(H2SiO3是白色沉淀)、H2SiO3![]() SiO2+H2O
SiO2+H2O
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的阳离子是______,一定不存在的阴离子是________。
(2)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)
阴离子 | ①___ | ②___ | ||
c/mol·L-1 | ____ | ___ |
(3)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素![]() 是一种重要的化工产品,工业生产尿素的主要流程如下:
是一种重要的化工产品,工业生产尿素的主要流程如下:
![]()
(1)工业合成氨的化学方程式是_______。
(2)尿素分子中C、N原子间的共用电子对偏向N原子,从原子结构的角度解释原因:______。
(3)由NH3和CO2合成尿素分为两步反应(均为可逆反应),其能量变化示意图如下:
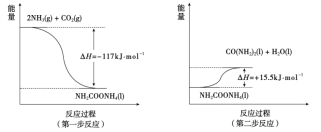
①合成尿素总反应的热化学方程式是_______。
②粗尿素中含有NH2COONH4杂质。通过控制温度和压强,可将NH2COONH4分解为NH3和CO2。研究温度和压强对NH2COONH4分解率的影响,结果如下:
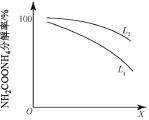
X代表_____(填“温度”或“压强”),L1_____L2(填“>”或“<”)。
(4)工业上含尿素的废水需经处理后才能排放。一种利用电化学方法降解尿素的装置示意图如下:
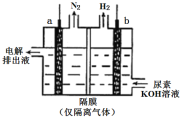
写出尿素被降解的电极反应式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com