
【题目】甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
(1)制取合成气的反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)H =+206 kJ/mol。
CO(g)+3H2(g)H =+206 kJ/mol。
向体积为2 L密闭容器中,按n(H2O)∶n(CH4)=1投料:
a.保持温度为T1时,测得CH4(g)的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,CH4的转化率随反应温度的变化如图2所示。

①结合图1,写出反应达平衡的过程中的能量变化:______kJ。
②在图1中画出:起始条件相同,保持温度为T2(T2> T1)时, c(CH4)随时间的变化曲线______。
③根据图2判断:
ⅰ. a点所处的状态不是化学平衡状态,理由是_______。
ⅱ. CH4的转化率:c>b,原因是________。
(2)熔融碳酸盐燃料电池的结构示意图如下。

①电池工作时,熔融碳酸盐中CO32-移向________(填“电极A”或“电极B”)
②写出正极上的电极反应:________。
(3)若不考虑副反应,1 kg甲烷完全转化所得到的合成气全部用于燃料电池中,外电路通过的电子的物质的量最大为_____mol。
【答案】吸收412(x-y) 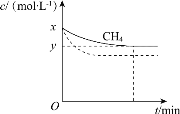 催化剂不能改变物质的平衡转化率 750℃时,反应相同时间,a点对应的CH4的转化率低于使用Ⅰ时CH4的转化率 电极A O2+4e-+2CO2=2CO32- 500
催化剂不能改变物质的平衡转化率 750℃时,反应相同时间,a点对应的CH4的转化率低于使用Ⅰ时CH4的转化率 电极A O2+4e-+2CO2=2CO32- 500
【解析】
(1)①结合图1,反应的甲烷的物质的量为(x-y)mol·L-1×2L=2(x-y)mol,反应达平衡的过程中的能量变化:吸收2(x-y)mol×216kJ·mol-1=412(x-y)kJ。故答案为:吸收412(x-y);
②起始条件相同,保持温度为T2(T2> T1)时,由于是吸热反应,升高温度,平衡正向移动,平衡时甲烷的浓度降低,但反应速率加快,平衡所用时间缩短, c(CH4)随时间的变化曲线 。故答案为:
。故答案为: ;
;
③根据图2:ⅰ. a点所处的状态不是化学平衡状态,理由是催化剂不能改变物质的平衡转化率。故答案为:催化剂不能改变物质的平衡转化率;
ⅱ. CH4的转化率:c>b,原因是750℃时,反应相同时间,a点对应的CH4的转化率低于使用Ⅰ时CH4的转化率。故答案为:750℃时,反应相同时间,a点对应的CH4的转化率低于使用Ⅰ时CH4的转化率;
(2)①氢气和一氧化碳作还原剂,发生氧化反应,电极A是电池的负极,电池工作时,熔融碳酸盐中阴离子CO32-移向负极,即电极A,故答案为:电极A;
②正极上氧化剂得电子,发生还原反应,正极上的电极反应:O2+4e-+2CO2=2CO32-。故答案为:O2+4e-+2CO2=2CO32-;
(3)若不考虑副反应,1 kg甲烷完全转化所得到的合成气全部用于燃料电池中,最终转化为CO2和水,甲烷中碳由-4价升高为+4价,氢化合价相当于没有变,外电路通过的电子的物质的量最大为![]() =500mol。故答案为:500。
=500mol。故答案为:500。


科目:高中化学 来源: 题型:
【题目】(1)有以下六种物质:①乙醇 ②![]() 溶液 ③
溶液 ③![]() 固体 ④液态氯化氢 ⑤纯
固体 ④液态氯化氢 ⑤纯![]() ⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
(2)![]() 和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
(3)配平下列化学方程式,在横线上填写化学计量数。
_________![]() _________
_________![]() _________
_________![]() =_________
=_________![]() _________
_________![]() _________
_________![]()
(4)已知反应:![]() ,当反应生成2.40gBr2时,电子转移的数目为____________。
,当反应生成2.40gBr2时,电子转移的数目为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
B. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
D. 升高温度,正向反应速率增加,逆向反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
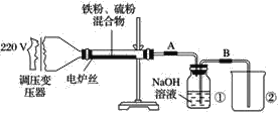
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验是中学化学的重要实验。
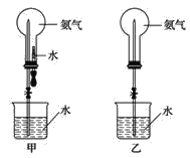
(1)实验室中常用图甲装置进行NH3的喷泉实验。用该装置完成喷泉实验的操作方法是_________。
(2)若用图乙装置进行NH3的喷泉实验,打开止水夹后,烧杯中的液体不能进入烧瓶。请写出引发喷泉实验的一种操作方法:____________。
(3)若将图甲装置中胶头滴管和烧杯中液体改为NaOH溶液,能用改动后的甲装置进行喷泉实验的一组气体是_________(填字母)。
A.HCl和CO2 B.Cl2和CO C.O2和SO2 D.NO2和NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g) ![]() CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(3)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
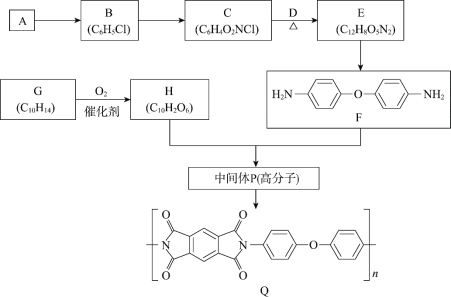
【题目】聚酰亚胺是一类非常有前景的可降解膜材料,其中一种膜材料Q的合成路线如下。
已知:i.![]() +
+![]()
![]()
![]() +
+![]()
ii.![]() +NaOH
+NaOH![]()
![]() +
+![]()
(1)A是芳香烃,A![]() B的化学方程式是________。
B的化学方程式是________。
(2)B转化为C的试剂和条件是________。
(3)C中所含的官能团的名称是________。
(4)D可由C与KOH溶液共热来制备,C与D反应生成E的化学方程式是________。
(5)E![]() F的反应类型是________。
F的反应类型是________。
(6)G与A互为同系物,核磁共振氢谱有2组峰,G![]() H的化学方程式是________。
H的化学方程式是________。
(7)H与F生成中间体P的原子利用率为100%,P的结构简式是________(写一种)。
(8)废弃的膜材料Q用NaOH溶液处理降解后可回收得到F和_______(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用硫代硫酸钠进行了相关的实验。
Ⅰ.已知:Na2S2O3+H2 SO4 Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2=____,V3=___;
(2)若V4=10.0,V5=6.0,则实验①、③可探究_____对反应速率的影响。
Ⅱ.利用反应:I2+2Na2S2O3 Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用amol/L的碘水滴定,消耗碘水b mL,则:
(3)滴定时,将碘水注入___(填“酸式”或“碱式”)滴定管中,滴定应选择的指示剂是____,滴定终点的现象为________。
(4)对于该滴定实验的有关操作或误差分析正确的是____。
a.滴定前,要用对应装入的溶液润洗锥形瓶和滴定管
b.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
c.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
d.滴定前仰视读数而滴定结束时平视读数,则所测得的纯度将会偏小
(5)样品中硫代硫酸钠纯度的表达式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com