
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g) ![]() CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(3)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
【答案】<△H2 - △H1bc(CH3 OH)c(H2 O)/ c(C O2)c3(H2)正向不变
【解析】
(1)由表中数据可知,随温度升高,平衡常数K减小,说明温度升高,平衡逆向进行,所以正向是放热反应,即△H1<0;根据盖斯定律,反应Ⅱ-反应Ⅰ得:C02(g)+H2(g)![]() CO(g)+H20(g)△H3=△H2- △H1;正确答案:< ;△H2 - △H1。
CO(g)+H20(g)△H3=△H2- △H1;正确答案:< ;△H2 - △H1。
(2)a.充入CO,使体系总压强增大,平衡向正反应移动,但CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡向正反应方向移动,CO转化率增大,b正确;
c.充入He,使体系总压强增大,各物质的浓度不变,平衡不移动,CO转化率不变,c错误;
d.使用高效催化剂,不能改变平衡,CO转化率不变,d错误;
正确选项b。
(3)反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)的平衡常数k=![]() ;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,根据等效平衡理论,相当于增大压强,则化学平衡正向移动,因为温度不变,平衡常数K也不变;正确答案:. c(CH3 OH)c(H2 O)/ c(C O2)c3(H2);正向; 不变。
;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,根据等效平衡理论,相当于增大压强,则化学平衡正向移动,因为温度不变,平衡常数K也不变;正确答案:. c(CH3 OH)c(H2 O)/ c(C O2)c3(H2);正向; 不变。


科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) 该反应为吸热反应。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) 该反应为吸热反应。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。

(1)t1时,正、逆反应速率的大小关系为ν正______ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=_________;
(3)下列条件的改变能减慢其反应速率的是______________(选填序号)
①降低温度 ②减少铁粉的质量
③保持压强不变,充入He使容器的体积增大
④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________________(选填序号)
①v(CO2)=v(CO)
②单位时间内生成n molCO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化
④容器中气体的平均分子量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A. X试剂可用Na2SO3饱和溶液
B. 步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C. 工业上每获得1molBr2,需要消耗Cl244.8L
D. 步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、R四种短周期元素,Y、Z、R同周期。相关信息如下:
相关信息 | |
X | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
Y | 含Y元素的物质焰色反应为黄色 |
Z | 同周期元素中原子半径最小 |
R | R元素原子的最外层电子数是K层电子数的3倍 |
(1)Z元素在周期表的位置是_____,Y、Z、R简单离子的半径从大到小的顺序是__________(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为 ___________;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为_______,写出乙溶液在空气中变质过程的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢分解反应过程中,能量变化如图所示:下列说法正确的是
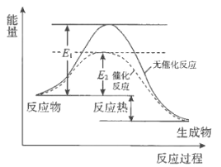
A. 催化剂可以改变过氧化氢分解反应的焓变
B. MnO2或FeCl3可以催化H2O2分解反应
C. 催化剂不能改变反应路径
D. H2O2分解是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验:
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是
A. 氧化性Cu2+>Fe3+
B. ①中所得固体只含铜
C. ①中滤液含有Cu2+和Fe2+
D. ②中不会观察到溶液变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com