
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
B. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
D. 升高温度,正向反应速率增加,逆向反应速率减小
科目:高中化学 来源: 题型:
【题目】常温下,现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为: pH(甲)___________pH(乙)(填“大于”、“小于”或“等于”)。
(2)各取25mL的甲、乙两溶液,分别用等浓度的 NaOH 稀溶液中和至 pH=7,则消耗的 NaOH 溶 液的体积大小关系为:V(甲)_____________V(乙)(填“大于”、“小于”或“等于”)。
(3)pH=2的醋酸溶液中由水电离出的c(H+)________0.01mol/LHCl溶液中由水电离出的c(H+)。(填“>”、“<”、或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素①~⑧的部分性质,下列说法正确的是

A. 元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
B. 元素④的最高价氧化物对应水化物的酸性比元素⑤的最高价氧化物对应水化物的酸性强
C. 元素①⑧形成的化合物具有两性
D. 上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程

下列说法中错误的是
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月16日,国土资源部召开新闻发布会,宣布天然气水合物,即“可燃冰”新矿种获得国务院批准,成为我国第173个矿种。“可燃冰”主要成分的分子式是CH4·8H2O,一旦温度升高或压强降低,甲烷气就会逸出,固体水合物便趋于崩解。“可燃冰”将成为人类的后续能源。
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是__________________。
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
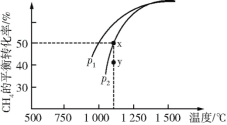
(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡____(填“向左”、“向右”或“不”)移动。
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
A.CH4 B.CO2
C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷 燃料电池的总反应式为______。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。
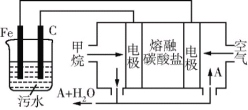
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) 该反应为吸热反应。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) 该反应为吸热反应。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。

(1)t1时,正、逆反应速率的大小关系为ν正______ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=_________;
(3)下列条件的改变能减慢其反应速率的是______________(选填序号)
①降低温度 ②减少铁粉的质量
③保持压强不变,充入He使容器的体积增大
④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________________(选填序号)
①v(CO2)=v(CO)
②单位时间内生成n molCO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化
④容器中气体的平均分子量不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中三种元素a、b、c在周期表中的位置如图所示,下列有关这三种元素的说法正确的是
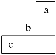
A. a是一种活泼的非金属元素B. b的气态氢化物比c的稳定
C. c的氧化物对应的水化物是强酸D. b元素的最高化合价为+7价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com