
【题目】高温下CO2和H2S发生如下反应:CO2(g) +H2S(g)COS(g) +H2O(g)。有关实验数据如下:
实验 | 温度 | 物质的起始物质的量/(mol) | 平衡时COS物质的量/(mol) | |
n(CO2) | n(H2S) | n(COS) | ||
I | 337℃ | 0.10 | 0.40 | 0.01 |
II | 347℃ | 0.10 | 0.40 | 0.015 |
下列说法不正确的是
A.该反应为吸热反应
B.实验I达平衡后COS的物质的量分数为5%
C.实验I温度下,反应的平衡常数为![]()
D.平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,相同温度下再达平衡时n(COS)=0.03mol
【答案】B
【解析】
A.根据表中数据可知,当二氧化碳和硫化氢的起始物质的量相同时,温度越高,COS的物质的量越大,说明温度越高,平衡向着吸热的方向移动,即COS的物质的量增大的方向为吸热的方向,正反应为吸热反应,故A正确;
B.根据实验I,写出反应三段式,
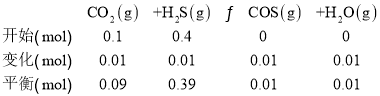
平衡后COS的物质的量分数=![]() ,故B错误;
,故B错误;
C.根据B项分析,反应的平衡常数为![]() ,故C正确;
,故C正确;
D.根据题意,列三段式:
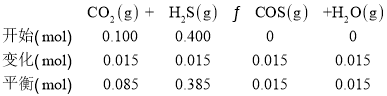
![]() , 平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,设转变的二氧化碳的物质的量为x,
, 平衡后向II中再充入0.10 mol CO2和0.40 mol H2S,设转变的二氧化碳的物质的量为x,
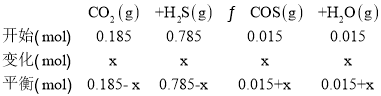
![]() ,x=0.015mol,相同温度下再达平衡时n(COS)=0.015mol+0.015mol=0.03mol,故D正确;
,x=0.015mol,相同温度下再达平衡时n(COS)=0.015mol+0.015mol=0.03mol,故D正确;
答案选B。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4molA和4molB在2L的密闭容器中发生如下反应:2A(g)+B(g)=2C(g)+D(g)。前15s,A的平均反应速率为0.12mol·(L·s)1,则15s时,容器中B的物质的量为( )
A.2.2molB.3.2molC.1.8molD.2.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
A | 氨水 | CaO | 无 | 制取并收集氨气 |
|
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Mn原子核外有__个未成对电子,M层的电子云有__种不同的伸展方向。金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“__理论”解释。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是__。
(3)NO![]() 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO![]() 的中心原子的杂化形式为__,空间构型为__。大π键可用符号
的中心原子的杂化形式为__,空间构型为__。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO
,则NO![]() 中大π键应表示为__。
中大π键应表示为__。
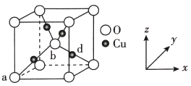
(4)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为__,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
),则d点的坐标参数为__,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com