
【题目】漂白粉和漂粉精是常用的消毒清洁用品,有效成分均为Ca(ClO)2,相应的生产流程如下。
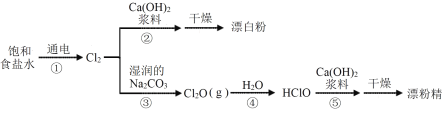
下列说法不正确的是
A.①中阳极的电极反应式为2Cl--2e-=Cl2↑
B.②中反应的化学方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
C.上述过程涉及氧化还原反应、化合反应、复分解反应
D.制备漂粉精过程中,Cl2转化为Ca(ClO)2时,Cl的原子利用率为100%
【答案】D
【解析】
饱和食盐水进行电解可以制得Cl2,将得到的Cl2分别与Ca(OH)2和Na2CO3反应经一系列流程可以分别制得漂白粉和漂粉精;电解过程中,溶液中的Cl-失电子生成氯气发生阳极反应,水中的H+得电子生成氢气发生还原反应,溶液中剩余氢氧化钠;氯气与氢氧化钙浆料反应生成次氯酸钙,同时还生成氯化钙;氯气与湿润的碳酸钠反应生成Cl2O,Cl2O与水发生化合反应生成HClO,HClO与氢氧化钙浆料反应生成次氯酸钙,据此分析。
A.电解过程中阳极失电子,溶液中Cl-发生阳极反应生成Cl2,阳极的电极方程式为2Cl--2e-=Cl2↑,A正确;
B.反应②为氯气和氢氧化钙的反应,反应方程式为2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,B正确;
C.上述过程中反应①②③为氧化还原反应,反应④为化合反应,反应⑤为复分解反应,C正确;
D.制备漂粉精过程中,Cl2转化为Ca(ClO)2时有CaCl2生成,Cl原子没有完全转化为Ca(ClO)2,因此Cl的原子利用率不为100%,D错误;
故选D。


科目:高中化学 来源: 题型:
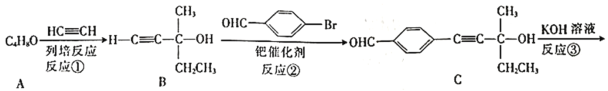
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:![]() +
+![]()
![]()
![]() 。我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如图所示:
。我国科研人员利用该反应设计合成了具有特殊结构的化合物F。合成线路如图所示:
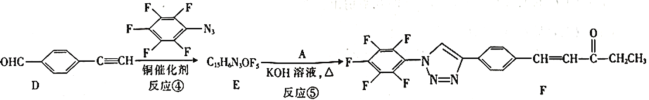
已知:![]() +
+
![]()
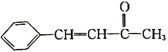 +H2O
+H2O
⑴A的名称是________。C中官能团的名称是________。
⑵反应④的反应类型为________。
⑶有机物分子中的1个碳原子上连接4个不同的原子或原子团时,该碳原子称为手性碳原子。上述流程中,存在手性碳原子的有机物有________(填字母)。
⑷反应③属于消去反应,反应③的化学方程式为________________。
⑸芳香族化合物G与C互为同分异构体,G的苯环上只有两个对位的取代基,且其中一个取代基为乙烯基(CH2=CH—)。G分子中只有两种官能团,且1molG与足量银氨溶液发生银镜反应生成4mol Ag,则G的结构有________种,其中核磁共振氢谱图中只有7组吸收峰的结构简式为________________(写出一种结构即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g) ![]() CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(3)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有1L0.1mol/LCuSO4溶液的大烧杯中,用锌、铜作电极,用导线连接形成原电池,当电极锌消耗3.25g时,试完成:
(1)写出电极反应式:负极__________________;正极____________。
(2)电极上析出铜的质量。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
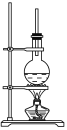
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.13 g13 C含有的中子数目为6 NA
B.常温下 ,I LpH =4的醋酸溶液所含离子总数为2 ×10-4NA
C.100 g质量分数为 98% 的磷酸中所含氧原子总数为4 NA
D.0.1 mol Fe 完全溶于稀硝酸,转移的电子数目为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com