
下列事实不能用平衡移动原理解释的是

B
【解析】
试题分析:A、向氯化银悬浊液中滴加碘化钾溶液,因为碘化银的溶解度小于氯化银,碘离子会和银离子反应生成碘化银沉淀,使得氯化银的沉淀溶解平衡正向移动,生成碘化银黄色沉淀,可以用化学平衡移动原理解释,错误;B、该反应是化学反应前后气体系数相等的反应,加压不会引起化学平衡的移动,颜色加深是因为体积减小引起碘的浓度增大导致的,不能用化学平衡移动原理解释,正确;C、啤酒中存在平衡H2CO3 H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,逸出二氧化碳气体,可以用平衡移动原理来解释,错误;D、氯气与水反应是可逆反应,饱和食盐水中氯离子浓度增大,抑制氯气与水的反应,平衡逆向移动,故可利用排饱和食盐水的方法收集氯气,可以用化学平衡移动原理解释,错误。
H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,逸出二氧化碳气体,可以用平衡移动原理来解释,错误;D、氯气与水反应是可逆反应,饱和食盐水中氯离子浓度增大,抑制氯气与水的反应,平衡逆向移动,故可利用排饱和食盐水的方法收集氯气,可以用化学平衡移动原理解释,错误。
考点:考查化学平衡移动原理、化学平衡的影响因素等。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:选择题
钠与水反应的现象和钠的下列性质无关的是
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第三次月考化学试卷(解析版) 题型:选择题
某1 L混合溶液中,溶质X、Y的浓度都为0.1 mol·L-1,向混合溶液中滴加某溶液Z(0.1 mol· L-1氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是
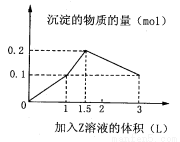
A.硫酸铝、硫酸铁、氢氧化钠
B.硫酸铝、硫酸镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:实验题
(10分)二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,实验装置如下图所示:
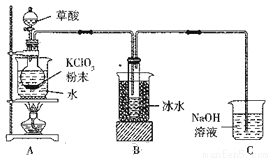
(1)装置A中还应安装的玻璃仪器是____,装置B用冰水浴的原因是________.
(2)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:________________.
(3)①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式:_____________________________。
②饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
a.____________________;b________________________;c.洗涤;d.干燥。
(4)还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省天一高三上学期大联考化学试卷(解析版) 题型:选择题
甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是

A.该装置为电能转化为化学能的装置
B.a电极发生的电极反应为CH3OH+H2O-6e-═CO2↑+6H+
C.当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D.将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:填空题
(10分)Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
①S2O32-能被I2氧化为无色的S4O62-;
②酸性条件下S2O32-迅速分解为S和SO2
I.市售Na2S2O3中常含有SO42-,请完成以下方案,检验其中含有的SO42-:
实验步骤 | 预期现象或结论 |
步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
步骤2:加入过量盐酸 | |
步骤3: | 有白色沉淀产生,说明样品中含有SO42- |
Ⅱ.利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.000g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL 0.01000mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③往步骤②所得溶液加入淀粉作指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2 === S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、 和 。
(2)完成并配平步骤②中的离子反应:
Cr2O72- + ( ) + I- === I2 + Cr3+ + H2O
(3)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是




A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:填空题
(选考)【化学——物质结构与性质】(15分)
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子1s轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是 ,该分子中含有____个 键。
键。
(2)Z原子的核外电子排布式为 ;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为 。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____晶体;W、Q、X三种元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是 。邻甲基苯甲醛分子中碳原子轨道的杂化类型为 。1 mol 苯甲醛分子中σ键为 mol。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。

该晶体中阳离子和阴离子个数比为____,晶体中每个Xn-被 个等距离的C+离子包围。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
X、Y、Z、M、W为五种短周期元素。它们在周期表的相对位置如下表:
M | |||||||
X | Y | Z | |||||
W |
则下列说法正确的是:
A.Y、M形成的气态化合物在标准状况下的密度为0.76 g.L-1
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质一定是原子晶体
D.XZ2、X2M2、W2Z2均为直线型的共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com