
【题目】二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,如图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①ClO2的浓度较大时易分解,实验室用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I+8H+=2Cl+5I2+4H2O。
③![]()

请回答:
(1)比较仪器c和d,实验中c的优点是___。
(2)制备装置甲中需改进的一项措施是___。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是___。
(4)下列有关说法正确的是___。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5ClO2-=Cl+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,ClO2的氧化能力是Cl2的2.5倍
(5)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000mol·L1Na2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I+S4O62-),达到滴定终点时用去20.00mLNa2S2O3标准溶液,测得该水样中ClO2的含量为___mg·L1。
【答案】有利于液体顺利流下,防止甲醇挥发 水浴加热 4NaClO3+CH3OH+2H2SO4![]() 2Na2SO4+4ClO2↑+HCOOH+3H2O
2Na2SO4+4ClO2↑+HCOOH+3H2O
(或者4NaClO3+CH3OH+4H2SO4![]() 4ClO2↑+HCOOH+4NaHSO4+3H2O) 产生的CO2可稀释ClO2,防止ClO2浓度较大时分解 ACD 270
4ClO2↑+HCOOH+4NaHSO4+3H2O) 产生的CO2可稀释ClO2,防止ClO2浓度较大时分解 ACD 270
【解析】
装置甲中甲醇,![]() ,硫酸反应生成
,硫酸反应生成![]() ,加入氢氧化钠后硫酸被中和反应即停止,稳定剂用于吸收
,加入氢氧化钠后硫酸被中和反应即停止,稳定剂用于吸收![]() ,加入盐酸释放
,加入盐酸释放![]() ,淀粉碘化钾溶液用于检验
,淀粉碘化钾溶液用于检验![]() ,氢氧化钠溶液用于尾气吸收。
,氢氧化钠溶液用于尾气吸收。
(1)d是分液漏斗,添加盐酸时需要将分液漏斗活塞打开,便于液体顺利流下,但会导致液体的挥发,c是恒压漏斗,有利于液体顺利流下,减少甲醇的挥发,
故答案为:有利于液体顺利流下,减少甲醇的挥发;
(2)甲装置需控制反应温度60℃,酒精灯直接加热不利于温度的控制,60℃低于水的沸点,可采取水浴加热,受热均匀,便于控制温度,
故答案为:水浴加热;
(3)甲醇被氧化为甲酸(![]() ),
),![]() 还原生成
还原生成![]() ,硫酸生成硫酸钠,反应方程式为:
,硫酸生成硫酸钠,反应方程式为: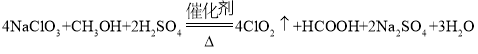 ,(或者4NaClO3+CH3OH+4H2SO4
,(或者4NaClO3+CH3OH+4H2SO4![]() 4ClO2↑+HCOOH+4NaHSO4+3H2O)
4ClO2↑+HCOOH+4NaHSO4+3H2O)
故答案为: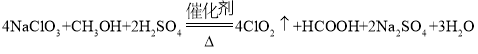 ,(或者4NaClO3+CH3OH+4H2SO4
,(或者4NaClO3+CH3OH+4H2SO4![]() 4ClO2↑+HCOOH+4NaHSO4+3H2O);
4ClO2↑+HCOOH+4NaHSO4+3H2O);
(4)A.![]() 可以中和硫酸并吸收
可以中和硫酸并吸收![]() ,A正确;
,A正确;
B.![]() 可以将碘离子氧化为碘单质,造成e中溶液显蓝色,故装置e的作用是检验是否产生
可以将碘离子氧化为碘单质,造成e中溶液显蓝色,故装置e的作用是检验是否产生![]() ,B错误;
,B错误;
C. 稳定剂吸收![]() ,生成
,生成![]() ,加盐酸后
,加盐酸后![]() 发生歧化反应释放
发生歧化反应释放![]() ,C正确;
,C正确;
D. 等物质的量的![]() 和
和![]() ,转移电子的物质的量之比为5:2,故
,转移电子的物质的量之比为5:2,故![]() 的氧化能力是
的氧化能力是![]() 的2.5倍,D正确;
的2.5倍,D正确;
答案选ACD;
(5)根据题目信息,![]() ,
,![]() 的物质的量为
的物质的量为![]() ,故
,故![]() 的物质的量为0.0004mol,质量为:
的物质的量为0.0004mol,质量为:![]() ,水样中
,水样中![]() 的含量为:
的含量为:![]() ,
,
故答案为:270


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】某化合物6.4g在氧气中完全燃烧,只生成8.8gCO2和7.2gH2O。下列说法正确的是( )
A.该化合物仅含碳、氢两种元素
B.该化合物中碳、氢原子个数比为1:8
C.无法确定该化合物是否含有氧元素
D.该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.![]() =1.0×1012的溶液中:Na+、Ca2+、C1O4-、CH3COO-
=1.0×1012的溶液中:Na+、Ca2+、C1O4-、CH3COO-
B.NH4Fe(SO4)2溶液中:H+、Mg2+、C1-、NO3-
C.水电离出的c(H+)=1.0×10-12molL-1的溶液中:K+、Al3+、Br-、SO42-
D.0.010molL-1Ba(OH)2溶液中:NH4+、Na+、C1-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,碳酸(H2CO3)的电离常数Ka1=4.5×10-7、Ka2=5.0×10-11。常温下,向20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1的盐酸40mL,溶液中含碳元素各微粒(CO2因逸出未画出)的物质的量分数随溶液pH的变化如图所示,下列说法错误的是( )

A.随着盐酸的加入,溶液中![]() 的值增大
的值增大
B.加入盐酸至溶液pH=8的过程中,水的电离程度逐渐减小
C.当pH=7时,溶液中c(Na+)>c(HCO3-)>cCl-)
D.当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2OH++OH-,在不同温度下其离子积为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14,则下列叙述中正确的是( )
A.c(H+)随温度的升高而降低
B.35℃时,c(H+)>c(OH-)
C.溶液pH:pH(35℃)>pH(25℃)
D.35℃时已电离的水的浓度约为1.45×10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将2mol A和2mol B两种气体混合加入2L密闭容器中,发生反应3A(g)+B(g)![]() 2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
2C(g)+2D(g)△H,2min末反应达到平衡,生成0.8mol D。(用三段式解答。)
(1)求该反应的平衡常数____。
(2)求平衡时A的转化率____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种有机物分别由碳、氢、氧元素中的两种或三种元素组成各取四种有机物0.1mol,分别完全燃烧,均能得到4.48 L(标准状况下)二氧化碳,D的水溶液显酸性。四种有机物转化关系如图:
![]()
回答下列问题:
(1)A、D分子中所含官能团的名称分别是______、______。
(2)a mol A、B的混合气体完全燃烧,消耗氧气的体积为______(标准状况)。
(3)B→C的化学方程式________,反应类型______。
(4)在实验室里可以用如图所示的装置制取乙酸乙酯。
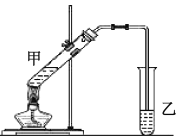
①写出用![]() 与乙酸发生酯化反应的化学方程式_________。
与乙酸发生酯化反应的化学方程式_________。
②反应开始前,试管乙中盛放的试剂为______,制乙酸乙酯时,试管甲中试剂加入顺序为______。
③合成乙酸乙酯的反应为放热反应,实验表明,反应温度应控制在85℃左右为宜。本实验温度不宜低于85℃左右的原因是________。
(5)对所得乙酸乙酯粗产品的提纯过程如下(已知:氯化钙与乙醇生成难溶物)。
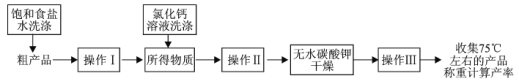
图中操作Ⅰ的名称为_______,操作Ⅱ的名称为_______,操作Ⅲ的名称为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com